
【題目】下列指定反應的離子方程式正確的是
A.用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑
B.向氯化鋁溶液中滴加過量氨水:Al3++4NH3·H2O=AlO-2+4NH+ 4+2H2O
C.向碳酸氫鈣溶液中加入少量燒堿溶液:Ca2++2HCO-3+2OH-=CaCO3↓+CO2-3+H2O
D.亞硫酸鈉溶液滴加到酸性高錳酸鉀溶液中:5SO2-3+6H++2MnO![]() =5SO2-4+2Mn2+ +3H2O
=5SO2-4+2Mn2+ +3H2O
科目:高中化學 來源: 題型:
【題目】甲烷廣泛存在于天然氣、沼氣、煤礦坑氣之中,是優質的氣體燃料,更是制造許多化工產品的重要原料。
Ⅰ.制取氫氣
已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+206.2kJ·mol-1
CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.4kJ·mol-1
2CO(g)+2H2(g) △H=+247.4kJ·mol-1
(1)請寫出CH4(g)與H2O(g)反應生成CO2(g)和H2(g)的熱化學方程式___________________
(2)若將0.1mol CH4和0.1mol H2O(g)通入體積為10L的密閉容器里,在一定條件下發生反應:CH4(g)+H2O(g)![]() CO(g)+3H2(g),CH4的平衡轉化率與溫度、壓強的關系如圖
CO(g)+3H2(g),CH4的平衡轉化率與溫度、壓強的關系如圖

①已知100℃時達到平衡所需的時間為5min,則用H2表示的平均反應速率_________;
②該反應的化學平衡常數___________________;
③圖中的p1 p2(填“<”、“>”或“=”);
Ⅱ.制備甲醇
(3)在壓強為0.1MPa條件下,將a mol CO與3amol H2的混合氣體在催化劑作用下能自發反應生成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H<0。若容器容積不變,下列措施可增加甲醇產率的是________;
CH3OH(g) △H<0。若容器容積不變,下列措施可增加甲醇產率的是________;
A.升高溫度
B.再充入1mol CO和3mol H2
C.將CH3OH(g)從體系中分離
D.充入He,使體系總壓強增大
E.使用更高效的催化劑
Ⅲ.合成乙酸
(4)甲烷直接合成乙酸具有重要的理論意義和應用價值。光催化反應技術使用CH4和 (填化學式)直接合成乙酸,且符合“綠色化學”的要求(原子利用率100℅)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在與外界隔離的體系中,自發過程將導致體系的熵 ,(填“增大”、“減小”、“不變”);對于同一種物質, 時熵值最大。(填“固態”、“液態”、“氣態”)
(2)某工廠實驗室用CO和H2制備CH3OH,其原理為:CO(g)+2H2(g) ![]() CH3OH(g) △H < 0該溫度下的化學平衡常數表達式_____________;若在298K、398K時化學平衡常數分別為K1、K2,則K1 K2(填“>”、“<”、“=”)
CH3OH(g) △H < 0該溫度下的化學平衡常數表達式_____________;若在298K、398K時化學平衡常數分別為K1、K2,則K1 K2(填“>”、“<”、“=”)
(3)M與N是同素異形體,由M=N;△H=+119KJ/mol可知,M比N________(填穩定、不穩定)
(4)一定溫度下,反應3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一密閉容器中進行達平衡后, 保持壓強不變,充入Ar,其正反應速率__________(A.變快 B.不變 C變慢,填字母代號);該反應向__________(填正移、逆移或不移)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人的胃液正常pH在1.2~0.3之間,酸度再高就患胃酸過多癥,下列物質不宜用作治療胃酸過多癥藥劑成分的是( )
A.氧化鎂粉 B.氫氧化鎂 C.氧化鈣 D.純碳酸鈣粉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】意大利羅馬大學的FulvioCacace等人獲得了極具理論研究意義的N4分子,下列說法正確的是( )
A.N4屬于一種新型的化合物
B.N4與N2的摩爾質量相等
C.等質量的N4與N2所含的原子個數比為1:1
D.等質量的N4與N2所含的原子個數比為2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應2A(g) + B(g) ![]() 2C(g)在反應過程中C的質量分WC隨溫度變化如圖所示,試確定:
2C(g)在反應過程中C的質量分WC隨溫度變化如圖所示,試確定:
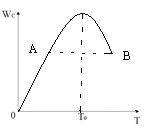
(1)T0對應的V正與V逆關系是V正___________V逆(填“>”、“<”、“=”)。
(2)A、B兩點正反應速率的大小關系VA___________VB(填“>”、“<”、“=”)。
(3)溫度T<T0時,Wc逐漸增大的原因是____________________;
(4)500℃條件下,該反應 K =2.33 ,測得某時刻,A(g)、B(g)、C(g)的濃度均為0.5mol/L,則此時v(正)____________v(逆)(填“>”“<”或“=”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com