
分析 (1)Mg和硝酸反應的產物是硝酸鎂、硝酸銨和水,據此書寫方程式;
(2)稀硫酸增重0.17g為氨氣的質量,根據氮原子守恒被氧化的硝酸與氨氣的物質的量相等;
(3)根據電子轉移數目守恒計算參加反應Mg的物質的量,再根據m=nM計算其質量;
(4)Mg與硝酸恰好完全反應生成Mg(NO3)2、NH4NO3,根據氮原子守恒可知原硝酸溶液中n(HNO3)=2n[Mg(NO3)2]+2n(NH4NO3),再根據c=$\frac{n}{V}$計算.
解答 解:(1)Mg和硝酸反應的產物是硝酸鎂、硝酸銨和水,即4Mg+10HNO3═4Mg(NO3)2+NH4NO3+3H2O,
故答案為:4Mg+10HNO3═4Mg(NO3)2+NH4NO3+3H2O;
(2)稀硫酸增重0.17g為氨氣的質量,其物質的量為0.01mol,根據氮原子守恒被氧化的硝酸與氨氣的物質的量相等為0.01mol,
故答案為:0.01;
(3)根據電子轉移守恒,參加反應Mg的物質的量=$\frac{0.01mol[5-(-3)]}{2}$=0.04mol,
故參加反應的Mg的質量為0.04mol×24g/mol=0.96g,
故答案為:0.96;
(4)Mg與硝酸恰好完全反應生成Mg(NO3)2、NH4NO3,生成氨氣為0.01mol,則n(NH4NO3)=0.01mol,Mg為0.04mol,則n[Mg(NO3)2]=0.04mol,
根據氮原子守恒可知原硝酸溶液中:n(HNO3)=2n[Mg(NO3)2]+2n(NH4NO3)=0.04mol×2+0.01mol×2=0.1mol,
故原硝酸的物質的量濃度為 $\frac{0.1mol}{0.2L}$=0.5mol/L,
故答案為:0.5.
點評 本題考查氧化還原反應的有關計算,難度中等,注意利用守恒思想進行的計算,本題可以利用方程式計算.


 一課一練課時達標系列答案
一課一練課時達標系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鉛蓄電池在充電過程中,陰極得到電子質量增加 | |
| B. | 1 mol羥基含電子數約為7×6.02×1023 | |
| C. | 0.1 mol•L-1 CH3COOH溶液加水稀釋后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值減小 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固體,CO32-水解程度減小,溶液的pH減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 據2016年11月2日科技日報報道,天宮二號伴隨衛星通過7次軌道控制,從天宮二號正上方飛越,并拍攝了多幅照片.拍攝照片的相機包括鏡頭和CCD(圖象傳感器)兩部 分,其中鏡頭的材料為玻璃,CCD為半導體材料.下列敘述正確的是( )
據2016年11月2日科技日報報道,天宮二號伴隨衛星通過7次軌道控制,從天宮二號正上方飛越,并拍攝了多幅照片.拍攝照片的相機包括鏡頭和CCD(圖象傳感器)兩部 分,其中鏡頭的材料為玻璃,CCD為半導體材料.下列敘述正確的是( )| A. | 玻璃和半導體材料均可由SiO2制備 | |
| B. | 普通玻璃的制備原料是純堿、黏土和石英 | |
| C. | 通訊傳輸的光導纖維是單晶硅 | |
| D. | 高溫下利用氧化劑可使SiO2轉化為Si |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯不能使酸性高錳酸鉀溶液褪色,所以苯不能發生氧化反應 | |
| B. | 1mol葡萄糖能水解生成2mol乙醇和2mol二氧化碳 | |
| C. | 戊烷的一氯代物和丙烷的二氯代物的同分異構體數目相同 | |
| D. | 異丙醇能發生取代反應、氧化反應、消去反應等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 起到殺菌作用 | B. | 使水中次氯酸分解 | ||
| C. | 提高水的溫度 | D. | 增加水中氧氣的含量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
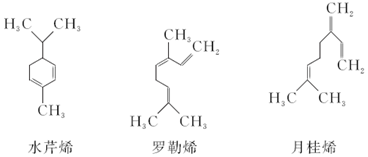
 →
→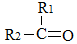
| A. | 三者互為同分異構體 | |
| B. | 三者與酸性KMnO4溶液反應的氧化產物中均有CO2 | |
| C. | 相同質量的三種物質與Br2發生加成反應消耗相同量的Br2 | |
| D. | 三者分子中所有碳原子均在同一個平面內 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除②外 | B. | 除③外 | C. | 除②③⑤⑥外 | D. | 除③⑥外 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 選項 | 實驗 | 現象 | 結論 |
| A | 向KI溶液中加入CCl4,振蕩后靜置 | 液體分層,下層呈紫紅色 | 碘易溶于CCl4,難溶于水 |
| B | 向某溶液中滴加BaCl2溶液,隨后加稀硝酸酸化 | 溶液中產生白色沉淀,加稀硝酸不溶解 | 原溶液中一定含有SO42- |
| C | 將稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液變黃色 | 氧化性:H2O2比Fe3+強 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固體 | 溶液紅色變淺 | 證明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol I2(s)中通入2 g H2(g),反應吸熱26.48 kJ | |
| B. | 1 mol固態碘與1 mol氣態碘所含的能量相差17.00 kJ | |
| C. | 反應(ⅱ)的反應物總能量比反應(ⅰ)的反應物總能量低 | |
| D. | 反應(ⅰ)放出的熱量多,所以產物的能量低,比反應(ⅱ)的產物更穩定 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com