
【題目】太陽能電池板材料除單晶硅外,還有銅、硒、氮、硼、鎵、鎂、鈣等化學物質。
(1)亞銅離子(Cu+)基態時的價電子排布式為__;
(2)氮元素的第一電離能在同周期中從大到小排第__位;寫出與NO3-互為等電子體的一種非極性分子化學式__;
(3)H2Se的酸性比H2S__(填“強”或“弱”)。
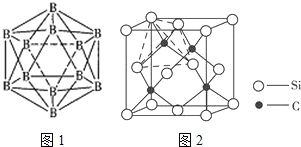
(4)晶體硼的結構單元是正二十面體,每個單元中有12個硼原子(如圖1),其中有兩個原子為10B,其余為11B,則該結構單元有__種不同的結構類型。
(5)如圖2為碳化硅的晶胞(其中●為碳原子,○為硅原子)。
①三個碳原子和三個硅原子相間構成一個__式(船、椅)六元環。
②如果我們以一個硅原子為中心,則與硅原子次近的第二層有___個原子。
③已知:碳原子半徑為a×10-8cm,硅子半徑為b×10-8cm,假設碳、硅原子是剛性小球,在晶體中彼此相切,計算碳化硅晶體的密度為__g/cm3(只要求列出算式),查表知該密度比實測值偏小,其原因可能是__。
(6)在濃的CrCl3的鹽酸溶液中加入乙醚,并通入HCl至飽和,可得到配位數為6,組成為CrCl36H2O的綠色晶體,該晶體中兩種配體的物質的量之比為1:5,則該配離子的化學式為____。
(7)難溶碳酸鹽受熱易分解,試比較MgCO3和CaCO3的穩定性,并說明理由__。
【答案】3d10 3 SO3等 強 3 椅 12 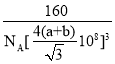 密度偏小,說明實際晶胞的體積下小于計算值,實際上碳、硅原子之間形成共價鍵,而不是相切,碳、硅原子間的距離比兩個原子半徑之和小 [TiCl(H2O)5]2+ CaCO3>MgCO3,碳酸鹽的熱分解是由于晶體中的陽離子結合碳酸根離子中的氧離子,使碳酸根離子分解為二氧化碳分子的結果,產物中氧化鎂和氧化鈣都為離子晶體,因為鎂離子半徑小于鈣離子半徑則氧化鎂晶格能大,更穩定,更易于生成
密度偏小,說明實際晶胞的體積下小于計算值,實際上碳、硅原子之間形成共價鍵,而不是相切,碳、硅原子間的距離比兩個原子半徑之和小 [TiCl(H2O)5]2+ CaCO3>MgCO3,碳酸鹽的熱分解是由于晶體中的陽離子結合碳酸根離子中的氧離子,使碳酸根離子分解為二氧化碳分子的結果,產物中氧化鎂和氧化鈣都為離子晶體,因為鎂離子半徑小于鈣離子半徑則氧化鎂晶格能大,更穩定,更易于生成
【解析】
(1)Cu原子價電子排布式為3d104s1,失去4s能級的1個電子形成Cu+;
(2)同一周期元素中,元素的第一電離能隨著原子序數的增大而呈增大趨勢,但第IIA族、第VA族元素第一電離能大于同周期相鄰元素的,稀有氣體的第一電離能最大;
原子數目相等、價電子總數也相等的微粒互為等電子體,分子中正負電荷重心重合的分子屬于非極性分子(中心原子價電子全部成鍵);
(3)Se的原子半徑大于S的,故H-Se不如H-S鍵穩定;
(4)兩個10B有3位置,為圖中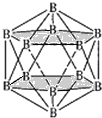 上下頂點位置,其中一個處于上頂點,另外的一個處于上層陰影中頂點,或者下層陰影中頂點;
上下頂點位置,其中一個處于上頂點,另外的一個處于上層陰影中頂點,或者下層陰影中頂點;
(5)①三個碳原子和三個硅原子相間構成一個六元環為圖中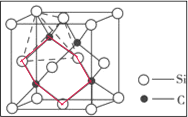 紅線連接的原子,為椅式結構;
紅線連接的原子,為椅式結構;
②距離中心Si最近的第一層的4個C原子,每一個又連接著另外3個Si原子;
③黑色球連接周圍的4個白色球形成正四面體結構,黑色球位于正四面體的中心,黑色球與晶胞頂點白色球連線處于晶胞體對角線上,且二者之間距離為體對角線長度的![]() ,而晶胞體對角線長度為晶胞棱長的
,而晶胞體對角線長度為晶胞棱長的![]() 倍,據此算晶胞棱長,根據均攤法計算晶胞中Si、C原子數目,表示出晶胞的質量,再根據ρ=
倍,據此算晶胞棱長,根據均攤法計算晶胞中Si、C原子數目,表示出晶胞的質量,再根據ρ=![]() 計算晶體密度;
計算晶體密度;
Si、C原子之間形成共價鍵,原子間距小于二者原子半徑之和,計算的體積比實際體積偏大;
(6)在濃的CrCl3的鹽酸溶液中加入乙醚,并通入HCl至飽和,可得到配位數為6、組成為CrCl36H2O的綠色晶體,該晶體中兩配體的物質的量之比為1:5,則配體中有1個Cl-、5個H2O,2個氯離子位于外界;
(7)分解生成金屬氧化物,金屬氧化物的晶格能大,更穩定,更易于生成。
(1)![]() 原子價電子排布式為
原子價電子排布式為![]() ,失去4s能級的1個電子形成
,失去4s能級的1個電子形成![]() ,
,![]() 基態時的價電子排布式為
基態時的價電子排布式為![]() ,故答案為:
,故答案為:![]() ;
;
(2)同一周期元素中,元素的第一電離能隨著原子序數的增大而呈增大趨勢,但第IIA族、第VA族元素第一電離能大于同周期相鄰元素的,稀有氣體的第一電離能最大,故第二周期第一電離能:![]() ,
,
原子數目相等、價電子總數也相等的微粒互為等電子體,與![]() 互為等電子體的一種非極性分子化為
互為等電子體的一種非極性分子化為![]() 等,
等,
故答案為:3;![]() 等;
等;
(3)![]() 的原子半徑大于S的,故H
的原子半徑大于S的,故H![]() 不如
不如![]() 鍵穩定,在溶液中更溶液電離,故H
鍵穩定,在溶液中更溶液電離,故H![]() 的酸性比
的酸性比![]() 強,
強,
故答案為:強;
(4)兩個![]() 有3位置,為圖中
有3位置,為圖中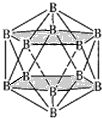 上下頂點位置,其中一個處于上頂點,另外的一個處于上層陰影中頂點,或者下層陰影中頂點,有3種結構,
上下頂點位置,其中一個處于上頂點,另外的一個處于上層陰影中頂點,或者下層陰影中頂點,有3種結構,
故答案為:3;
(5)①三個碳原子和三個硅原子相間構成一個六元環為圖中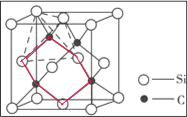 紅線連接的原子,為椅式結構,
紅線連接的原子,為椅式結構,
故答案為:椅;
②距離中心Si最近的第一層的4個C原子,每一個又連接著另外3個Si原子,則與硅原子次近的第二層有12個原子,
故答案為:12;
③黑色球連接周圍的4個白色球形成正四面體結構,黑色球位于正四面體的中心,黑色球與晶胞頂點白色球連線處于晶胞體對角線上,且二者之間距離為體對角線長度的![]() ,而晶胞體對角線長度為晶胞棱長的
,而晶胞體對角線長度為晶胞棱長的![]() 倍,故晶胞棱長為
倍,故晶胞棱長為![]() ,晶胞中C原子數目為4,Si原子數目為
,晶胞中C原子數目為4,Si原子數目為![]() ,故晶胞質量為
,故晶胞質量為![]() ,故晶體密度為
,故晶體密度為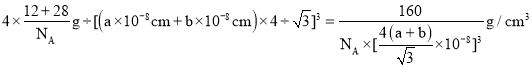 ,
,
密度偏小,說明實際晶胞的體積下小于計算值,實際上碳、硅原子之間形成共價鍵,而不是相切,碳、硅原子間的距離比兩個原子半徑之和小,
故答案為: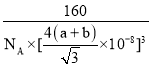 ;密度偏小,說明實際晶胞的體積下小于計算值,實際上碳、硅原子之間形成共價鍵,而不是相切,碳、硅原子間的距離比兩個原子半徑之和小;
;密度偏小,說明實際晶胞的體積下小于計算值,實際上碳、硅原子之間形成共價鍵,而不是相切,碳、硅原子間的距離比兩個原子半徑之和小;
(6)在濃的![]() 的鹽酸溶液中加入乙醚,并通入HCl至飽和,可得到配位數為6、組成為TiCl3
的鹽酸溶液中加入乙醚,并通入HCl至飽和,可得到配位數為6、組成為TiCl3![]() H2O的綠色晶體,該晶體中兩配體的物質的量之比為1:5,則配體中有1個
H2O的綠色晶體,該晶體中兩配體的物質的量之比為1:5,則配體中有1個![]() 、5個
、5個![]() ,2個氯離子位于外界,則該配離子的化學式為
,2個氯離子位于外界,則該配離子的化學式為![]() ,
,
故答案為:![]() ;
;
(7)碳酸鹽的熱分解是由于晶體中的陽離子結合碳酸根離子中的氧離子,使碳酸根離子分解為二氧化碳分子的結果,產物中氧化鎂和氧化鈣都為離子晶體,因為鎂離子半徑小于鈣離子半徑則氧化鎂晶格能大,更穩定,更易于生成,穩定性:![]() ,
,
故答案為:穩定性:![]() ,碳酸鹽的熱分解是由于晶體中的陽離子結合碳酸根離子中的氧離子,使碳酸根離子分解為二氧化碳分子的結果,產物中氧化鎂和氧化鈣都為離子晶體,因為鎂離子半徑小于鈣離子半徑則氧化鎂晶格能大,更穩定,更易于生成。
,碳酸鹽的熱分解是由于晶體中的陽離子結合碳酸根離子中的氧離子,使碳酸根離子分解為二氧化碳分子的結果,產物中氧化鎂和氧化鈣都為離子晶體,因為鎂離子半徑小于鈣離子半徑則氧化鎂晶格能大,更穩定,更易于生成。


科目:高中化學 來源: 題型:
【題目】X、Y、Z、P、Q為五種短周期元素,其原子半徑和最外層電子數之間的關系如下圖所示。下列說法正確的是

A. Q的氧化物一定含有離子鍵和共價鍵 B. 最高價含氧酸的酸性:Z<Y
C. P的最低價氫化物常溫常壓下為液體 D. Y形成的化合物種類最多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】小王要制備純凈的二氧化碳氣體,可供選用的儀器如圖所示。可供選用的藥品如下:①石灰石②澄清石灰水③稀硫酸④濃硫酸⑤鹽酸溶液⑥燒堿溶液⑦蒸餾水。下列裝置連接順序及組合最恰當的是( )

A. A(①⑤)、B(④)、C(⑦)、DB. A(①③)、B(④)、C(⑦)、D
C. A(①⑤)、B(⑦)、C(④)、DD. A(①⑤)、B(⑥)、C(④)、D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在120℃、101kPa條件下,由H2、CH4組成的混合氣體amL,通入一定量(設為xmL)氧氣使其完全燃燒。
(1)若amL混合氣體完全燃燒消耗相同條件下氧氣的體積也為amL(即x=a),則原混合氣體中CH4的體積分數是_____(保留三位有效數字);
(2)若原混合氣體完全燃燒時,生成的氣體中只有CO2和H2O(g),則x的取值范圍是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】前四周期A、B、C、D、E、F、G原子序數依次增大,A元素的質子數和質量數相等,B元素具有三個能級且所排電子數相同,D元素2p能級上電子數是2s能級的兩倍;D和E相鄰且同主族.F是第四周期未成對電子最多的原子,G是目前使用量最多的金屬。
請回答下列問題:![]() 用推出的元素符號或者化學式作答
用推出的元素符號或者化學式作答![]()
(1)F的價電子排布式為__,B、C、D三種元素的第一電離能從大到小的順序為___,D和E電負性較大的是__。
(2)BD32-中B原子的雜化方式為__,該離子的空間構型為__,鍵角為___。
(3)寫出一種由A、C、D組成且既含離子鍵又含共價鍵的物質的化學式__,化合物ABC中σ鍵和π鍵數目之比為___,C的氣態氫化物在一定的壓強下,測得的密度比該壓強下理論密度略大,請解釋原因__。
(4)B和C的最高價含氧酸的酸性較強的是___,過量的G與C的最高價含氧酸稀溶液反應的離子方程式為__。
(5)E和G形成的某種晶胞如圖所示:其中白球表示E,黑球表示G。則該物質的化學式為___,假設該晶胞的密度為ρg/cm3,用NA表示阿伏加德羅常數,則該晶胞中距離最近的G原子之間的距離為___cm。
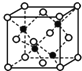
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,向2L密閉容器中加入2molX、1molY。發生如下反應:2X(g)+Y(?) ![]() 3Z(g) H<0。經60s達平衡,此時Y的物質的量為0.2mol。下列說法正確的是
3Z(g) H<0。經60s達平衡,此時Y的物質的量為0.2mol。下列說法正確的是
A. 反應開始至平衡時,用X表示的化學反應速率為1.2 mol/(L·min)
B. 該反應平衡常數表達式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新達平衡時X的體積分數一定增大
D. 若使容器體積變為1 L,Z的物質的量濃度一定增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖裝置中,U形管內為紅墨水,a、b試管內分別盛有食鹽水和醋酸溶液,各加入生鐵塊,放置一段時間。下列有關描述不正確的是
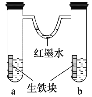
A.生鐵塊中的碳是原電池的正極
B.紅墨水水柱兩邊的液面變為左低右高
C.兩試管中相同的電極反應式是Fe-2e- = Fe2+
D.a試管中發生了吸氧腐蝕,b試管中發生了析氫腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將a g由CO和H2組成的混合氣體在足量的O2中充分燃燒后,將生成的所有產物通過足量的Na2O2固體,Na2O2固體增加的質量為
A. a g B. ![]() g
g
C. ![]() g D.
g D. ![]() g
g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】0.1 mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中的H2A、HA-、A2 -的物質的量分數δ(x)隨pH的變化如圖所示。下列說法錯誤的是

A.pH =1.9時,c(Na+)<c(HA-)+2c(A2-)
B.當c(Na+)=c(H2A)+c(HA-)+c(A2-)時,溶液pH>7
C.pH=6時,c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.lg[Ka2(H2A)]=-7.2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com