
【題目】實驗室里用硫酸廠燒渣(主要成分為鐵的氧化物及少量FeS、SiO2等)來制備綠礬(FeSO4·7H2O)和聚鐵(堿式硫酸鐵的聚合物),其過程如下:

(1)若用濃硫酸配制過程①所需的250mL3.0mol·L-1的稀硫酸,所用的玻璃儀器除燒杯、玻璃棒和量筒外,還需要_____。
(2)過程②用到多種硅酸鹽質的儀器,除玻璃棒、酒精燈、泥三角外,還有_____(填儀器名稱),該過程產生的尾氣會對大氣造成污染,可選用下列試劑中的_____吸收。
a.濃硫酸 b.蒸餾水 c.NaOH溶液 d.濃硝酸
(3)過程③中,需要加入的物質名稱是____,檢驗溶液X中金屬陽離子是否完全轉化的試劑為_____(填試劑名稱)。
(4)過程④的操作是將溶液______、_____、過濾、洗滌,即得到FeSO4·7H2O晶體。過程⑥中,將溶液Z加熱到70~80℃,目的是__。
(5)實驗室為測定所得到的聚鐵樣品中鐵元素的質量分數,進行下列實驗。①用分析天平稱取樣品2.700g;②將樣品溶于足量鹽酸后,加入足量的氯化鋇溶液;③過濾、洗滌、干燥、稱量,得固體質量為3.495g。若該聚鐵主要成分為[Fe(OH)SO4]n,則該聚鐵中鐵元素的質量分數為____。
【答案】250mL容量瓶、膠頭滴管 坩堝 c 鐵 硫氰化鉀溶液 蒸發(濃縮) (冷卻)結晶 促進Fe3+的水解 31.11%
【解析】
燒渣中加入稀硫酸、同時通入氧氣,過濾后,得到固體W中含有S、SiO2,再灼燒后尾氣中含有二氧化硫,溶液X含有硫酸鐵及未反應的硫酸,溶液X中加入Fe粉,反應完畢,過濾得到溶液Y為FeSO4溶液,再經過蒸發濃縮、冷卻結晶、過濾、洗滌等得到綠礬。溶液X調節pH得到溶液Z,加熱促進Fe3+的水解得到聚鐵膠體,再經過膠體聚沉得到聚鐵,以此解答該題。
(1)用濃硫酸配制250 mL 3.0 mol·L-1的稀硫酸,應用250 mL的容量瓶,最后定容時需用膠頭滴管;故答案為:250mL容量瓶、膠頭滴管;
(2)實驗室中灼燒固體可以在坩堝中進行;固體W燃燒生成的污染物是SO2,用堿液吸收;故答案為:坩堝;c;
(3)從流程圖可知,溶液X中的鐵元素以Fe3+存在,綠礬中的鐵元素為Fe2+形式,故應加入鐵粉,將Fe3+還原為Fe2+,檢驗溶液中是否還含有Fe3+的試劑是硫氰化鉀溶液;故答案為:鐵;硫氰化鉀溶液;
(4)將溶液Y蒸發濃縮,得到高濃度的FeSO4溶液,然后經冷卻結晶即可得到FeSO4·7H2O晶體。升高溫度促進Fe3+的水解,若溫度過低,Fe3+水解程度低不利于聚鐵的生成,若溫度太高,Fe3+完全水解則不利于聚鐵的形成;故答案為:蒸發(濃縮);(冷卻)結晶;促進Fe3+的水解;
(5)③得到的沉淀是BaSO4,n(BaSO4)=3.495g÷233g/mol=0.015mol,根據聚鐵主要成分為[Fe(OH)SO4]n,推出n(Fe3+)=0.015mol,則m(Fe3+)=0.84 g,鐵元素的質量分數:w(Fe)=(0.84 g/2.700 g)×100%=31.11%,故答案為:31.11%。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】如圖為直流電源電解稀Na2SO4水溶液的裝置。通電后在石墨電極a和b附近分別滴加幾滴石蕊溶液。下列實驗現象中正確的是( )

A.逸出氣體的體積,a電極的小于b電極的
B.一電極逸出無味氣體,另一電極逸出刺激性氣味氣體
C.a電極附近呈紅色,b電極附近呈藍色
D.a電極附近呈藍色,b電極附近呈紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組做乙醛和新制氫氧化銅的反應時,發現NaOH的用量對反應產物有影響,于是他們采用控制變量的方法,均使用0.5 mL 40%的乙醛溶液進行下列實驗。
乙醛溶液進行下列實驗.
編號 | 2%CuSO4溶液的體積 | 10%NaOH溶液的體積 | 振蕩后 | pH | 加乙醛水浴加熱后的沉淀顏色 |
1 | 2mL | 3滴 | 淺藍綠色沉淀 | 5~6 | 淺藍綠色沉淀 |
2 | a | 15滴 | 淺藍色沉淀 | 7~8 | 黑色沉淀 |
3 | 1mL | 1mL | 藍色懸濁沉淀較少 | 9~10 | 紅褐色沉淀 |
4 | b | 2mL | 藍色懸濁沉淀較多 | 11~12 | 紅色沉淀 |
5 | 1mL | 3mL | 藍紫色溶液 | 12~13 | ---- |
(1)上表中a、b應為(填字母序號)。___________________
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查閱資料可知,實驗1中的淺藍綠色沉淀的主要成份為Cu2(OH)2SO4,受熱不易分解。寫出生成Cu
(3)小組同學推測實驗3中的紅褐色沉淀可能是CuO和Cu2O的混合物,其依據是___________。
(4)由實驗4可以得出結論:當NaOH的用量較大時,新制氫氧化銅可以與乙醛發生反應,生成Cu2O紅色沉淀。該反應的化學方程式為_________。
(5)為了進一步證明實驗4中紅色沉淀的成分,該小組同學查閱資料得知:Cu2O在堿性條件下穩定,在酸性溶液中可轉化為Cu2+、Cu。并進行了以下實驗。
ⅰ.將實驗4反應后的試管靜置,用膠頭滴管吸出上層清液。
ⅱ.向下層濁液中加入過量稀硫酸,充分振蕩、加熱,應觀察到的現象是_______________。
(6)小組同學繼續查閱資料得知:Cu(OH)2可與OH-繼續反應生成藍紫色溶液([Cu(OH)4]2-),由此提出問題:[Cu(OH)4]2-能否與乙醛發生反應,生成紅色沉淀?設計實驗解決這一問題,合理的實驗步驟是__________________基于上述實驗,該小組同學獲得結論:乙醛參與反應生成紅色沉淀時,需控制體系的pH>10。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學用已知濃度的鹽酸來測定某氫氧化鈉樣品的純度(雜志不參與反應),試根據實驗回答下列問題:
(1)準確稱量5.0 g含有少量易溶雜質的樣品,配成1L待測溶液。稱量時,樣品可放在________(填字母)稱量。
A.小燒杯中 B.潔凈紙片上 C.托盤上
(2)滴定時,用0.100 0 mol·L-1的鹽酸來滴定待測溶液,可選用________作指示劑。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定過程中氫氧化鈉溶液放在錐形瓶中,則鹽酸應該放在_______(填“甲”或“乙”)中。該同學選用酚酞做指示劑,如何判斷達到滴定終點:_______________________________。

(4)根據下表數據,計算被測燒堿溶液的物質的量濃度是______________ mol·L-1,燒堿樣品的純度是_______________。
滴定次數 | 待測溶液 體積(mL) | 標準酸體積 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 10.50 |
第二次 | 10.00 | 4.10 | 14.00 |
第三次 | 10.00 | 2.50 | 14.00 |
(5)下列實驗操作會對滴定結果產生什么后果?(填“偏高”“偏低”或“無影響”)
①觀察酸式滴定管液面時,開始平視,滴定終點俯視,則滴定結果______________。
②滴定前酸式滴定管尖嘴處有氣泡,滴定后氣泡消失,則滴定結果______________。
③洗滌后錐形瓶未干燥,則滴定結果______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電滲析法是一種利用離子交換膜進行海水淡化的方法,其原理如圖所示,電極為惰性電極。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等離子。下列敘述中正確的是( )

A. A膜是陽離子交換膜
B. 通電后,海水中陰離子往b電極處移動
C. 通電后,b電極上產生無色氣體,溶液中出現白色沉淀
D. 通電后,a電極的電極反應式為4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,現有0.1 mol/L的NH4HCO3溶液,pH =7.8。已知含氮(或含碳)各微粒的分布分數(平衡時某種微粒的濃度占各種微粒濃度之和的分數)與pH的關系如下圖所示。下列說法不正確的是

A. 常溫下Kb(NH3·H2O)> Kal(H2CO3)
B. 向pH =6.5的上述溶液中逐滴滴加NaOH溶液時,NH4+和HCO3一濃度都逐漸減小
C. NH4HCO3溶液中存在下列守恒關系:c( NH4+) +c( NH3·H2O) =c(HCO3-)+c(CO3 2-)+c( H2 CO3)
D. 當溶液的pH =9時,溶液中存在下列關系:c(HCO3-)>c(NH4+>c(NH3·H2O)>c(CO3 2-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作及現象能夠達到對應實驗目的是( )
選項 | 實驗操作及現象 | 實驗目的 |
A | 向溶液中加入鹽酸無現象,再加入氯化鋇溶液產生白色沉淀 | 檢驗溶液中有 |
B | 常溫下,向飽和 | 證明常溫下, |
C | 常溫下,測定鹽酸和醋酸溶液的pH:鹽酸pH小于醋酸pH | 證明相同條件下,在水中HCl電離程度大于 |
D | 將濃硫酸與碳混合加熱,直接將生成的氣體通入足量的澄清石灰水,石灰水變渾濁 | 檢驗氣體產物中 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列說法正確的是( )
A. 將CH3COONa溶液從20℃升溫至30℃,溶液中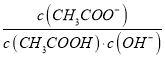 增大
增大
B. 用相同濃度的NaOH溶液分別滴定等體積pH均為3的HCOOH和CH3COOH溶液至終點,消耗NaOH溶液的體積相等
C. 0.2 mol/L HCOOH 與 0.1 mol/L NaOH 等體積混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 與 0.1 mol/L鹽酸等體積混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com