
| A. | 已知冰的融化熱為6.0kJ.mol-1,冰中氫鍵鍵能為20kJ.mol-1.假設每摩爾冰中有2 mol 氫鍵,且熔化熱完全用于打破冰的氫鍵,則最多只能破壞冰中15%的氫鍵 | |
| B. | 已知一定溫度下,醋酸溶液的物質的量濃度為c,電離度為a,Ka=$\frac{(ca)^{2}}{c(1-a)}$.若加入少量CH3COONa固體,則電離平衡CH3COOH?CH3COO-+H+向左移動,a減小,Ka變小 | |
| C. | 實驗測得環己烷(1).環己烯(1)和苯(1)的標準燃燒熱分別為-3916kJ.mol-1、-3747kJ.mol-1和-3265kJ.mol-1,可以證明在苯分子中不存在獨立的碳碳雙鍵 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═92Fe(s)+3CO(g)△H=489.0kJ.mol-1 CO(g)+$\frac{1}{2}$O2(g)═9CO2(g)△H=-283.0kJ.mol-1 C(石墨)+O2(g)═9CO2(g)△H=-393.5kJ.mol-1 則4Fe(s)+3O2(g)=94Fe2O3(s)△H=-1641.0kJ.mol-1 |
分析 A.冰中含有氫鍵和H、O共價鍵,熔化時克服氫鍵,化學鍵不變;
B.加入少量CH3COONa固體,抑制醋酸的電離,并Kα表達式分析;
C.以燃燒熱判斷鍵能及鍵型很不可靠;
D.根據蓋斯定律來分析熱化學反應方程式及焓變.
解答 解:A.冰的熔化熱為6.0kJ•mol-1,冰中氫鍵鍵能為20kJ•mol-1,則熔化破壞的氫鍵為:$\frac{6}{20×2}$×100%=15%,故A正確;
B.根據表達式Ka=$\frac{(ca)^{2}}{c(1-a)}$可知,增加CH3COONa固體,則電離平衡向左移動α減小,Kα的分子變小,分母變大故Kα減小,故B正確;
C.根據標準燃燒熱的含義:1mol液體充分燃燒生成二氧化碳和液態水,但①消耗的氧氣的量不同,產生的二氧化碳和水的量也不同,②苯中存在大π鍵,使鍵能升高,③若不考慮其他因素則:三種物質的內能應當是環己烷最低、苯次之、環己烯最高,而且燃燒熱的結果是苯最小.根據以上結論,以燃燒熱判斷鍵能及鍵型很不可靠,故C錯誤;
D.根據蓋斯定律可知,③×6-①×2-②×6得到目標式,則△H=-1641.0kJ•mol-1,故D正確;
故選C
點評 本題是關于計算的綜合題,熟悉鍵能與熔化熱、燃燒熱判斷鍵型的應用、電離度與電離平衡常數、反應熱的蓋斯定律計算等知識即可解答,注意做好各種相關計算教學是定量理解原理的意義所在,各知識點的計算都要達到理解、應用式計算而不是流于形式的簡單算計,側重考查各種反應量的計算能力.


 小學學習好幫手系列答案
小學學習好幫手系列答案 小學同步三練核心密卷系列答案
小學同步三練核心密卷系列答案科目:高中化學 來源: 題型:實驗題
| 反應時間/min | n(CO)/mol | n (H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
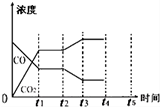
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
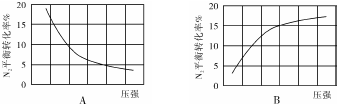
| 組別 | 溫度 | N2起始量/mol | N2的物質的量/mol | ||||||
| 5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
| Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
| Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
| Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
| Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| A | B | C | |
| D | E | F |
 ,實驗室制取氣體甲的化學方程式為2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,實驗室制取氣體甲的化學方程式為2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 32gO2和32gO3所含原子數目都為2NA | |
| B. | 標準狀況下,11.2 L水中含有的原子數是1.5NA | |
| C. | 0.1 mol Fe參與化學反應轉移的電子數一定為0.3NA | |
| D. | 在同溫同壓下,相同體積的任何氣體單質所含的原子數相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4LH2O含有的分子數為NA | |
| B. | 常溫常壓下,32g O2含有的氧原子數為2NA | |
| C. | 通常狀況下,NA個CO2分子占有的體積為22.4L | |
| D. | 1L 0.1mol/L NaCl溶液中所含的Na+為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 摩爾質量g/mol | B. | 氣體摩爾體積L/mol | ||
| C. | 溶解度g/100g | D. | 物質的量濃度mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com