
 導學全程練創優訓練系列答案
導學全程練創優訓練系列答案科目:高中化學 來源: 題型:
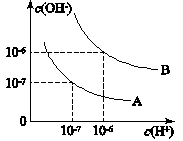
 已知水在25℃和95℃時,其電離平衡曲線如圖所示:
已知水在25℃和95℃時,其電離平衡曲線如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:
 已知水在25℃和95℃時,其電離平衡曲線如圖所示:
已知水在25℃和95℃時,其電離平衡曲線如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:
 已知水在25℃和99℃時,其電離平衡曲線如圖所示:
已知水在25℃和99℃時,其電離平衡曲線如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
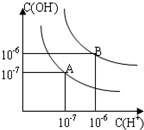 已知水在25℃和95℃時,其電離平衡曲線如圖所示:
已知水在25℃和95℃時,其電離平衡曲線如圖所示:查看答案和解析>>
科目:高中化學 來源:2011-2012學年湖南省望城縣第一中學高二上學期期末質量檢測化學試卷 題型:填空題
(6分)已知水在25℃和99℃時,其電離平衡曲線如右圖所示:
(1)則25 時水的電離平衡曲線應為______(A或B)。
(2)25時,將=9的NaOH溶液與=4的H2SO4溶液混合,若所得混合溶液的=7,則NaOH溶液與H2SO4溶液的體積比為____________。
(3)99時,若100體積1=的某強酸溶液與1體積
2=b的某強堿溶液混合后溶液呈中性,則混合前,與b之間應滿足的關系是____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com