
【題目】某學習小組研究溶液中Fe2+的穩定性,進行如下實驗,觀察,記錄結果。

實驗Ⅰ
物質 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黃色 | 桔紅色 | 紅色 | 深紅色 |
(NH4)2Fe(SO4)2 | 幾乎無色 | 淡黃色 | 黃色 | 桔紅色 |
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_______(用化學用語表示)。溶液的穩定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”) 。
(2)甲同學提出實驗Ⅰ中兩溶液的穩定性差異可能是(NH4)2Fe(SO4)2溶液中的NH4+保護了Fe2+,因為NH4+具有還原性。進行實驗Ⅱ,否定了該觀點,補全該實驗。
操作 | 現象 |
取_______,加_______,觀察。 | 與實驗Ⅰ中(NH4)2Fe(SO4)2溶液現象相同。 |
(3)乙同學提出實驗Ⅰ中兩溶液的穩定性差異是溶液酸性不同導致,進行實驗Ⅲ:分別配制0.80 mol·L-1 pH為1、2、3、4的FeSO4溶液,觀察,發現pH=1的FeSO4溶液長時間無明顯變化,pH越大,FeSO4溶液變黃的時間越短。
資料顯示:亞鐵鹽溶液中存在反應 4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+
4Fe(OH)3+8H+
由實驗III,乙同學可得出的結論是_______,原因是_______。
(4)進一步研究在水溶液中Fe2+的氧化機理。測定同濃度FeSO4溶液在不同pH條件下,Fe2+的氧化速率與時間的關系如圖(實驗過程中溶液溫度幾乎無變化)。反應初期,氧化速率都逐漸增大的原因可能是_____。

(5)綜合以上實驗,增強Fe2+穩定性的措施有_______。
【答案】NH4++H2O![]() NH3·H2O+H+ < 取2 mL pH=4.0的0.80 mol·L-1 FeSO4溶液 加2滴0.01 mol·L-1 KSCN溶液 溶液pH越小,Fe2+越穩定 溶液中存在平衡4Fe2++O2+10H2O
NH3·H2O+H+ < 取2 mL pH=4.0的0.80 mol·L-1 FeSO4溶液 加2滴0.01 mol·L-1 KSCN溶液 溶液pH越小,Fe2+越穩定 溶液中存在平衡4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+, c(H+)大,對平衡的抑制作用強,Fe2+更穩定 生成的Fe(OH)3對反應有催化作用 加一定量的酸;密封保存
4Fe(OH)3+8H+, c(H+)大,對平衡的抑制作用強,Fe2+更穩定 生成的Fe(OH)3對反應有催化作用 加一定量的酸;密封保存
【解析】
(1)(NH4)2Fe(SO4)2溶液和FeSO4中的Fe2+濃度相同,但中(NH4)2Fe(SO4)2含有濃度較高的NH4+;通過表格中的顏色變化來分析;
(2)由于是要驗證兩溶液的穩定性差異是否是由于(NH4)2Fe(SO4)2溶液中的NH4+保護了Fe2+導致,根據控制變量法可知,應除了讓NH4+這個影響因素外的其它影響因素均保持一致,據此分析;
(3)由實驗Ⅲ可知,溶液的pH越小,溶液的酸性越強,則Fe2+越穩定;亞鐵鹽溶液中存在反應4Fe2++O2+10H2O4Fe(OH)3+8H+,根據平衡的移動來分析;
(4)根據影響反應速率的因素有濃度、壓強、溫度和催化劑來分析;
(5)根據上述實驗來分析。
(1)(NH4)2Fe(SO4)2溶液和FeSO4中的Fe2+濃度相同,但(NH4)2Fe(SO4)2溶液中含有濃度較高的NH4+,NH4+水解顯酸性,導致(NH4)2Fe(SO4)2中的pH更小;通過表格中的顏色變化可知(NH4)2Fe(SO4)2中的Fe2+被氧化的速率更慢,即溶液的穩定性:FeSO4<(NH4)2Fe(SO4)2,故答案為:NH4++H2O![]() NH3H2O+H+;<;
NH3H2O+H+;<;
(2)由于是要驗證兩溶液的穩定性差異是否是由于(NH4)2Fe(SO4)2溶液中的NH4+保護了Fe2+導致,根據控制變量法可知,應除了讓NH4+這個影響因素外的其它影響因素均保持一致,故應取2mLpH=4.0的0.80molL-1FeSO4溶液于試管中,加2滴0.01molL-1KSCN溶液,過若觀察到的現象與實驗Ⅰ中(NH4)2Fe(SO4)2溶液現象相同,則說明上述猜想不正確,故答案為:取2mLpH=4.0的0.80molL-1FeSO4溶液;加2滴0.01molL-1KSCN溶液;
(3)由實驗Ⅲ可知,溶液的pH越小,溶液的酸性越強,則Fe2+越穩定;亞鐵鹽溶液中存在反應4Fe2++O2+10H2O![]() 4Fe(OH)3+8H+,溶液的pH越小,則氫離子濃度越大,平衡左移,則Fe2+的氧化被抑制,故答案為:溶液pH越小,Fe2+越穩定;溶液中存在平衡4Fe2++O2+10H2O
4Fe(OH)3+8H+,溶液的pH越小,則氫離子濃度越大,平衡左移,則Fe2+的氧化被抑制,故答案為:溶液pH越小,Fe2+越穩定;溶液中存在平衡4Fe2++O2+10H2O![]() 4Fe(OH)3+8H+,c(H+)大,對平衡的抑制作用強,Fe2+更穩定;
4Fe(OH)3+8H+,c(H+)大,對平衡的抑制作用強,Fe2+更穩定;
(4)影響反應速率的因素有濃度、壓強、溫度和催化劑,而同一條曲線上的濃度FeSO4溶液相同,且應隨著反應的進行,Fe2+的濃度減小,故不是濃度對反應速率的影響;而此反應為溶液中的反應,故壓強對此反應速率無影響;而此反應中溫度不變,故能影響反應速率的只有催化劑,故唯一的可能原因是生成的Fe(OH)3對反應有催化作用,故答案為:生成的Fe(OH)3對反應有催化作用;
(5)根據上述實驗可知,加入一定量的酸會抑制Fe2+的氧化,或是隔絕空氣密封保存,故答案為:加入一定量的酸,密封保存。


科目:高中化學 來源: 題型:
【題目】氮化硼(BN)晶體有多種相結構。六方相氮化硼是通常存在的穩定相,與石墨相似,具有層狀結構,可作高溫潤滑劑。立方相氮化硼是超硬材料,有優異的耐磨性。它們的晶體結構如右圖所示。
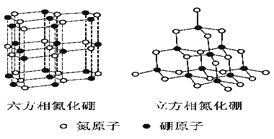
⑴基態硼原子的電子排布式為______________________________。
⑵ 關于這兩種晶體的說法,正確的是_________________(填序號)。
a.立方相氮化硼含有σ鍵和π鍵,所以硬度大 b.六方相氮化硼層間作用力小,所以質地軟
c.兩種晶體中的B-N鍵均為共價鍵 d.兩種晶體均為分子晶體
⑶六方相氮化硼晶體層內一個硼原子與相鄰氮原子構成的空間構型為________,其結構與石墨相似卻不導電,原因是______________________________。
⑷立方相氮化硼晶體中,硼原子的雜化軌道類型為___________________。該晶體的天然礦物在青藏高原在下約300Km的古地殼中被發現。根據這一礦物形成事實,推斷實驗室由六方相氮化硼合成立方相氮化硼需要的條件應是____________________________。
⑸NH4BF4(氟硼酸銨)是合成氮化硼納米管的原料之一。1mo NH4BF4含有_____________mol配位鍵。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】久置的FeSO4溶液變黃,一般認為是二價鐵被氧化為三價鐵的緣故。某研究小組為研究溶液中Fe2+被O2氧化的過程,查閱資料發現:溶液中Fe2+的氧化過程分為先后兩步,首先是Fe2+水解,接著水解產物被O2氧化。于是小組同學決定研究常溫下不同pH對Fe2+被O2氧化的影響,并測定了Fe2+氧化率隨時間變化的關系,結果如圖。回答下列問題:
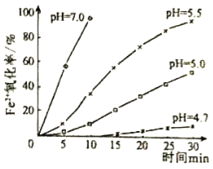
(1)寫出Fe2+水解的離子方程式______;要抑制FeSO4水解,可以采取的措施是______。
(2)在酸性條件下,Fe2+被O2氧化的反應方程式為:4Fe2++O24Fe3++2H2O,已知常溫下該反應的平衡常數很大。則下列說法正確的是______。
a.Fe2+轉化為Fe3+的趨勢很大 b.Fe2+轉化為Fe3+的速率很大
c.該反應進行得很完全 d.酸性條件下Fe2+不會被氧化
(3)結合如圖分析不同pH對Fe2+被O2氧化的反應發生了怎樣的影響______。
(4)研究小組在查閱資料時還得知:氧氣的氧化性隨溶液的酸性增強而增強。通過以上研究可知,配制FeSO4溶液的正確做法是______。
(5)用K2Cr2O7標準溶液測定溶液中Fe2+濃度,從而計算Fe2+的氧化率。反應如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O若取20mL待測溶液,用0.0200molL-1KCr2O7標準溶液滴定,消耗標準溶液16.50mL,則溶液中c(Fe2+)=______molL-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳、氮元素是構成生物體的主要元素,在動植物生命活動中起著重要作用。根據要求回答下列問題:
(1)處于一定空間運動狀態的電子在原子核外出現的概率密度分布可用____________形象化描述。在基態14C原子中,核外存在____________對自旋狀態相反的電子。
(2)已知:(NH4)2CO3![]() 2NH3↑+H2O↑+CO2↑
2NH3↑+H2O↑+CO2↑
①與氧同周期,且第一電離能比氧大的元素有____________種。
②(NH4)2CO3分解所得的氣態化合物分子的鍵角由小到大的順序為____________(填化學式)。
(3)物質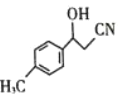 中C原子雜化方式是____________。
中C原子雜化方式是____________。
(4)配合物[Cu(CH3C![]() N)4]BF4中,銅原子的價電子布式為____________,BF4-的空間構型為___________。寫出與BF4-互為等電子體的一種分子和一種離子的化學式:___________、___________。
N)4]BF4中,銅原子的價電子布式為____________,BF4-的空間構型為___________。寫出與BF4-互為等電子體的一種分子和一種離子的化學式:___________、___________。
(5)碳元素與氮元素形成的某種晶體的晶胞如圖所示(8個碳原子位于立方體的頂點,4個碳原子位于立方體的面心,4個氮原子在立方體內),該晶體硬度超過金剛石,成為首屈一指的超硬新材料。
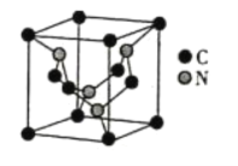
①晶胞中C原子的配位數為___________。該晶體硬度超過金剛石的原因是___________。
②已知該晶胞的邊長為apm,阿伏加德羅常數用NA表示,則該晶體的密度為___________g·cm-3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿伏加德羅常數的值為![]() 。下列說法正確的是
。下列說法正確的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的數量為0.1
的數量為0.1![]()
B. 2.4gMg與H2SO4完全反應,轉移的電子數為0.1![]()
C. 標準狀況下,2.24LN2和O2的混合氣體中分子數為0.2![]()
D. 0.1mol H2和0.1mol I2于密閉容器中充分反應后,其分子總數為0.2![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用氟硼酸(HBF4,屬于強酸)代替硫酸做鉛蓄電池的電解質溶液,可使鉛蓄電池在低溫下工作時的性能更優良,反應方程式為:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O;Pb(BF4)2為可溶于水的強電解質,下列說法正確的是
2Pb(BF4)2+2H2O;Pb(BF4)2為可溶于水的強電解質,下列說法正確的是
A.充電時,當陽極質量減少23.9g時轉移0.2 mol電子
B.放電時,PbO2電極附近溶液的pH增大
C.電子放電時,負極反應為PbO2+4HBF4-2e-=Pb(BF4)2+2HF4-+2H2O
D.充電時,Pb電極的電極反應式為PbO2+H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學--選修5:有機化學基礎]
氰基丙烯酸酯在堿性條件下能快速聚合為 ,從而具有膠黏性,某種氰基丙烯酸酯(G)的合成路線如下:
,從而具有膠黏性,某種氰基丙烯酸酯(G)的合成路線如下:

已知:
①A的相對分子量為58,氧元素質量分數為0.276,核磁共振氫譜顯示為單峰
②
回答下列問題:
(1)A的化學名稱為_______。
(2)B的結構簡式為______,其核磁共振氫譜顯示為______組峰,峰面積比為______。
(3)由C生成D的反應類型為________。
(4)由D生成E的化學方程式為___________。
(5)G中的官能團有___、 ____ 、_____。(填官能團名稱)
(6)G的同分異構體中,與G具有相同官能團且能發生銀鏡反應的共有_____種。(不含立體異構)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2013年中國水周的主題是:“節約保護水資源,大力建設生態文明”.
(1)ClO2和Cl2(還原產物都為Cl﹣)是生活中常用的凈水消毒劑.當消耗等物質的量的兩種物質時,ClO2的消毒效率是Cl2的_________倍.
(2)某無色廢水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的幾種,為分析其成分,分別取廢水樣品100mL,進行了三組實驗,其操作流程和有關現象如圖所示:操作③的相關圖象如圖
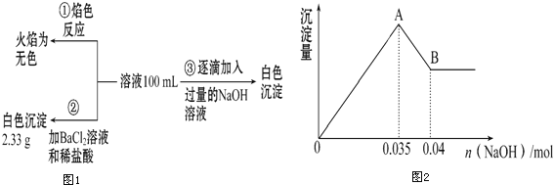
請根據上圖回答下列問題:
①實驗中需配制1.0molL﹣1的NaOH溶液100mL,所需儀器除了玻璃棒、托盤天平、量筒、藥匙、燒杯、膠頭滴管,還缺少的儀器為_______________.
②實驗③中沉淀量由A→B過程中所發生反應的離子方程式為___________.
③試確定NO3-是否存在?________(填“存在”“不存在”或“不確定”),若存在,試計算c(NO3-)=_____(若不存在,此問不必作答).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從能量的變化和反應的快慢等角度研究反應:2H2+O2=2H2O
(1)為了加快該反應速率,不能采取的措施有________(填序號,下同)。
A.使用催化劑 B.適當提高氧氣的濃度 C.擴大容器的體積 D.適當降低反應的溫度
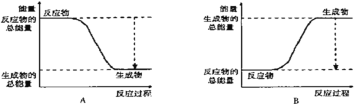
(2)該反應屬于______反應(填“吸熱”和“放熱”)。
下圖能正確表示該反應中能量變化的是________。
(3)氫氧燃料電池如圖所示:
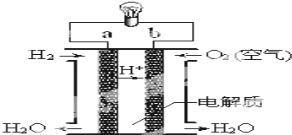
①a為________(填“正極”或“負極”),b電極發生_____反應(填“氧化”或“還原”);
②外電路中電子從b電極___,(填“流入”或“流出”),內電路中陽離子移向____極 (填”a”或”b”);
③寫出該裝置中正極上的電極反應式:___________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com