
【題目】在水的電離平衡中,c(H+)和c(OH)的關系如圖所示:

(1)A點水的離子積為1×1014,B點水的離子積為________。造成水的離子積變化的原因是___________________________________________。
(2)100 ℃時,若向溶液中滴加鹽酸,能否使體系處于B點位置?為什么?_______________________。
(3)100 ℃時,若鹽酸中c(H+)=5×104 mol·L1,則由水電離產生的c(H+)是________。
 陽光課堂課時優化作業系列答案
陽光課堂課時優化作業系列答案科目:高中化學 來源: 題型:
【題目】某研究小組以對氨基苯乙酮為原料,按下列路線合成藥物中間體E:
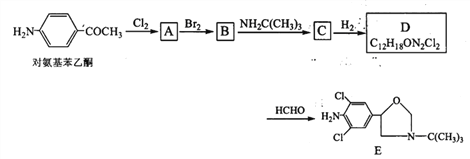
已知:
請回答:
(1)化合物A的分子式是______________。
(2)下列說法正確的是 ____________。
A.對氨基苯乙酮→A的反應條件是光照
B. A→B是發生了加成反應
C.D可以繼續和氫氣發生反應
D.—定條件下,化合物E與鹽酸和氫氧化鈉都可以發生反應
(3) D→E的化學方程式是_______________________。
(4) 1-(4-氨基苯基)乙醇也是藥物中間體,由對氨基苯乙酮和氫氣1:1加成可得。寫出同時符合
下列條件的1-(4-氨基苯基)乙醇的所有同分異構體的結構簡式_________________ 。
①可以和氯化鐵溶液發生顯色反應:②1H-NMR譜表明分子中有4種氫原子;
(5)設計以丙酮和一溴甲烷為原料制備NH2C(CH3)3的合成路線(用流程圖表示,無機試劑任選)__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖1是細胞中化合物含量的扇形圖,圖2是有活性的細胞中元素含量的柱形圖。下列說法錯誤的是( )

A. 若圖1表示正常細胞中化合物含量,則A、B共有的元素中在活細胞中含量最多的是圖2中的a
B. 若圖1表示干細胞中化合物含量,則A中含量最多的元素為圖2中的b
C. 若圖1表示正常細胞中化合物含量,則B具有多樣性,其必含的元素為C、H、O、N
D. 細胞中含量最多的元素是圖2中的a,數量最多的也是a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綠礬(FeSO4·7H2O)是治療缺鐵性貧血的特效藥。下面是以商品級純度鐵屑(含少量錫等雜質)生產綠礬的一種方法:

已知:在H2S飽和溶液中,SnS沉淀完全時溶液的pH為1.6;FeS開始沉淀時溶液的pH為3.0,沉淀完全時的pH為5.5。
(1)檢驗得到的綠礬晶體中是否含有Fe3+的實驗操作是_________。
(2)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是_________;通入硫化氫至飽和的目的是:①除去操作Ⅰ所得溶液中含有的Sn2+等雜質離子;②_________。
(3)操作Ⅳ的順序依次為_________、冷卻結晶、_________。
(4)操作Ⅳ得到的綠礬晶體用少量冰水洗滌,其目的是:①除去晶體表面附著的硫酸等雜質;②__________。
(5)測定綠礬產品中Fe2+含量的方法是:a.稱取2.850 g綠礬產品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待測溶液于錐形瓶中;c.用硫酸酸化的0.010 00 mol/L KMnO4溶液滴定至終點,消耗KMnO4溶液體積的平均值為20.00 mL(滴定時KMnO4溶液只與Fe2+發生反應)。
①計算上述樣品中FeSO4·7H2O的質量分數為_________(保留4位有效數字)。
②若用上述方法測定的樣品中FeSO4·7H2O的質量分數偏低(測定過程中產生的誤差可忽略),其可能原因有__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關表示正確的是( )
A.過氧化鈣(CaO2)的電子式: ![]()
B.某微粒的結構示意簡圖為 ![]() ,則該元素在周期表中位于第三周期、VIA族
,則該元素在周期表中位于第三周期、VIA族
C.H2CO3的電離方程式:H2CO32H++CO32﹣
D.葡萄糖的結構簡式:C6H12O6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“重整碳九"是指含有9個碳原子的芳香烴,分子式為C9H12的芳香烴中,含有兩個側鏈的同分異構體有
A. 1種 B. 2種 C. 3種 D. 4種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出元素在周期表中的位置,離子結構示意圖以及粒子半徑大小比較
(1)Al元素在周期表中的位置;S元素在周期表中的位置 .
(2)S2﹣電子式
(3)粒子半徑比較:Mg2+O2﹣ , Mg2+Ca2+ .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com