
【題目】按要求完成下列各題
(1)工業上制取粗硅的化學反應方程式_________________
(2)實驗室用氯氣制取少量“84”消毒液方程式________________
(3)銅和濃硫酸化學反應方程式_________________
(4)二氧化硅與氫氧化鈉溶液反應的離子方程式_________________
(5)用電子式表示氯化鎂的形成過程__________________
【答案】SiO2+2C![]() Si+2CO↑ Cl2+2NaOH
Si+2CO↑ Cl2+2NaOH![]() NaCl+NaClO+H2O Cu+2H2SO4(濃)
NaCl+NaClO+H2O Cu+2H2SO4(濃)![]() CuSO4+SO2↑+2H2O SiO2+2OH-
CuSO4+SO2↑+2H2O SiO2+2OH-![]() SiO32- +H2O
SiO32- +H2O 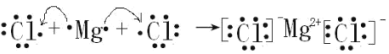
【解析】
在書寫方程式時要注意反應條件,反應物和生成物的狀態,還要審清題,看要求寫離子方程式還是化學方程式。
(1)工業上制取粗硅是用碳與二氧化硅在高溫下反應生成硅和一氧化碳,方程式為SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(2)“84”消毒液的有效成分為NaClO,實驗室用氯氣和氫氧化鈉溶液反應生成NaClO,反應方程式為Cl2+2NaOH![]() NaCl+NaClO+H2O;
NaCl+NaClO+H2O;
(3)銅和濃硫酸在加熱的條件下反應生成二氧化硫、硫酸銅和水,反應方程式為Cu+2H2SO4(濃)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)二氧化硅與氫氧化鈉溶液反應生成硅酸鈉和水,反應的離子方程式為iO2+2OH-![]() SiO32- +H2O;
SiO32- +H2O;
(5)氯化鎂是離子化合物,用電子式表示氯化鎂的形成過程時有電子的得失,其表達式為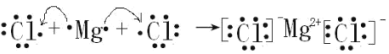 ;
;


科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列說法中正確的是
A. 常溫常壓下,56g丙烯與環丁烷的混合氣體中含有4NA個碳原子
B. 25℃,pH=1的H2SO4溶液中,H+的數目為0.2NA
C. 標準狀況下,0.1molCl2溶于水,轉移的電子數目為0.1NA
D. 1mol的P4O6中含有6 NA個P-O鍵(P4O6的結構如圖: ![]() )
)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,反應2A(g)![]() B(g) ΔH>0,在密閉容器中達到平衡,平衡后c(A)/c(B)=a,若改變某一條件,足夠長時間后反應再次達到平衡狀態,此時c(A)/c(B=b,下列敘述正確的是( )
B(g) ΔH>0,在密閉容器中達到平衡,平衡后c(A)/c(B)=a,若改變某一條件,足夠長時間后反應再次達到平衡狀態,此時c(A)/c(B=b,下列敘述正確的是( )
A. 在該溫度下,保持容積固定不變,向容器內補充了B氣體,則a<b
B. 若a=b,則容器中可能使用了催化劑
C. 若其他條件不變,升高溫度,則a<b
D. 若保持溫度、壓強不變,充入惰性氣體,則a>b
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各項比較中前者高于(或大于或強于)后者的是( )
A. PH3和AsH3的熔點
B. Br2在水中的溶解度和Br2在CCl4溶液中的溶解度
C. 對羥基苯甲醛(![]() )和鄰羥基苯甲醛(
)和鄰羥基苯甲醛(![]() )的沸點
)的沸點
D. HClO和HClO4的酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】F2和Xe在一定條件下可生成XeF2、XeF4和XeF6三種氟化氙,它們都是極強的氧化劑(其氧化性依次遞增),都極易水解,其中:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑,下列推測正確的是( )
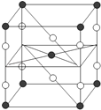
A. XeF2分子中各原子均達到8電子穩定結構
B. 某種氟化氙的晶體結構單元如右圖,可推知其化學式為XeF2
C. XeF4按已知方式水解,每生成3molO2,共轉移12mol電子
D. XeF2加入水中,在水分子作用下將重新生成Xe和F2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將28.8g銅與150mL一定濃度的硝酸反應,銅完全溶解,產生的NO和NO2混合氣體在標準狀況下的體積為11.2L。請回答:
(1)NO的體積為___L,NO2的體積為___L;
(2)待產生的氣體全部釋放,向溶液中加入200mL5mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部轉化成沉淀,則原硝酸溶液的濃度為___mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹵素化學豐富多彩,能形成鹵化物、鹵素互化物、多鹵化物等多種類型的化合物。
(1)鹵素互化物如IBr、ICl等與鹵素單質結構相似、性質相近。Cl2、IBr、ICl沸點由髙到低的順序為___,I和Cl相比,電負性較大的是___。
(2)碘原子價電子的電子排布圖為___。
(3)I3+屬于多鹵素陽離子,推測 I3+的空間構型為___,中心I原子的雜化軌道類型為___。
(4)請推測①HClO4、②HIO4、③H5IO6[可寫成(HO)5IO]三種物質的酸性由強到弱的順序為___(填序號)。
(5)離子化合物RbICl2存在復合陰離子,且晶體結構與NaCl相似,晶胞邊長為685.5pm(1pm=10-12m),RbICl2晶胞中含有___個氯原子,RbICl2晶體的密度是___gcm-3(只要求列算式,不必計算出數值, 阿伏伽德羅常數為NA)。
(6)三氯化鐵常溫下為固體,熔點282℃,沸點315℃,在300℃以上易升華。易溶于 水,也易溶于乙醚、丙酮等有機溶劑。據此判斷三氯化鐵晶體為____。
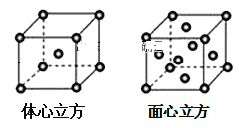
(7)金屬鐵的晶體在不同溫度下有兩種堆積方式,晶胞分別如圖所示。面心立方晶胞和體心立方晶胞中實際含有的鐵原子個數之比為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)硝基苯甲酸乙酯在OH-存在下發生水解反應:O2NC6H4COOC2H5+OH-O2NC6H4COO-+C2H5OH。兩種反應物的初始濃度均為0.050 mol·L-1,15℃時測得O2NC6H4COOC2H5的濃度c隨時間變化的數據如下表所示。回答下列問題:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
c/mol/L | 0.050 | 0.036 | 0.030 | 0.026 | 0.022 | 0.017 | 0.016 | 0.015 | 0.015 |
計算該反應在120~180s間的平均反應速率v(OH-)=_________;比較120~180s與180~240 s 區間的平均反應速率的大小,前者___________后者(填>,<或=),理由是:____________。
(2)某研究小組在實驗室將一定量純凈的氨基甲酸銨置于特制的密閉真空容器中(假設容器體積不變,溫度恒定,固體試樣體積忽略不計),t1時刻,反應:NH2COONH4(s)2NH3(g)+CO2(g)達到分解平衡。請在圖中畫出容器內NH3和CO2的物質的量濃度隨時間變化的趨勢圖:_________
(3)工業上合成尿素的反應為:2NH3(g)+CO2(g)CO(NH2)2(s) +H2O(g) 。在一定溫度和壓強下,往容積可變的密閉容器內通入物質的量各為1mol的氨氣和二氧化碳發生上述反應。下列說法中能說明該反應一定達到化學平衡的是_______________。
A.斷裂amol的N—H鍵的同時消耗a/2 mol的尿素
B.密閉容器中二氧化碳的體積分數保持不變
C.密閉容器中混合氣體的密度保持不變
D.密閉容器中混合氣體的平均摩爾質量保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中可能含有如下離子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。當向該溶液中逐滴加入NaOH溶液時,產生沉淀的物質的量(n)與加入NaOH溶液的體積(V)的關系如圖所示,下列說法正確的是( )

A. 原溶液中一定含有的陽離子是H+、Mg2+、Al3+、NH4+
B. 反應最后形成的溶液中的溶質含AlCl3
C. 原溶液中Al3+與NH的物質的量之比為1∶3
D. 原溶液中含有的陰離子是Cl-、AlO2-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com