
下列物質的除雜方 案正確的是( )
案正確的是( )
選項 | 被提純的物質 | 雜質 | 除雜試劑 | 除雜方法 |
A | CO2 (g) | SO2(g) | 飽和Na2CO3溶液、濃H2SO4 | 洗氣 |
B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 過濾 |
C | KNO3(s) | NaCl(s) | AgNO3溶液 | 過濾 |
D | Cu(s) | Ag(s) | CuSO4溶液 | 電解法 |
科目:高中化學 來源:2016-2017學年河北省饒陽縣高一上期中化學試卷(解析版) 題型:選擇題
向含有KI、NaBr的混合溶液中通入過量的Cl2充分反應。將溶液蒸干并灼燒,最后剩余的固體物質是( )
A.KI和NaBr B.KCl和NaCl C.KCl和NaBr D.KCl、NaCl和I2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年貴州省高一上期中化學卷(解析版) 題型:選擇題
下列電離方程式錯誤的是 ( )
A.NaHCO3 = Na++H++CO32- B.NaHSO4 = Na++H++SO42-
C.Mg(NO3)2 = Mg2++2NO3- D.Na2SO4 = 2Na++SO42-
查看答案和解析>>
科目:高中化學 來源:2016-2017學年貴州省高二上期中化學卷(解析版) 題型:選擇題
已知HCN(aq)與NaOH(aq)反應生成1 mol正鹽的ΔH=-12.1 kJ/mol;強酸、強堿的稀溶液反應的中和熱ΔH=-57.3 kJ·mol-1。則HCN在水溶液中電離的ΔH等于( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·m ol-1 D.+45.2 kJ·mol-1
ol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長株潭岳益五市十校高三12月聯考化學卷(解析版) 題型:填空題
(1)汽車劇烈碰撞時,安全氣囊中發生反應NaN3+KNO3→K2O+Na2O+X↑(未配平),已知X為單質,在反應中NaN3失去電子.則該反應的氧化劑為______,X的化學式為______.
(2)工業上制取高純度MnO2的某一步驟如圖所示:
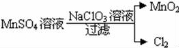
請寫出該反應的離子方程式__ ___.
(3)草酸鈣晶體(CaC2O4•H2O)可用作分離稀有金屬的載體.
①在一定溫度下向2L的密閉容器放入足量草酸鈣(固體所占體積忽略不計)發生反應:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min內生成CaO的質量為11.2g,則該段時間內v(CO)=__________mol•L﹣1•min﹣1;當反應達到平衡后,將容器體積壓縮到原來的一半,則下列說法正確的是__________(填答案選項編號).
A.平衡不移動,CaO的質量不變
B.平衡發生移動,且CaC2O4的分解率增大
C.平衡發生移動,但CO和CO2的濃度都沒有改變
D.平衡向逆反應方向移動,且該反應的化學平衡常數減小
②某溫度下,向0.3mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液體積變化),充分攪拌,發生反應:CO32﹣(aq)+CaC2O4(s)?CaCO3(s)+C2O42﹣(aq).靜置后沉淀轉化達到平衡.求此時溶液中的c(C2O42﹣)= mol•L﹣1.已知:該溫度下,KSP(CaC2O4)=5.0×10﹣9;KSP(CaCO3)=2.5×10﹣9.
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長株潭岳益五市十校高三12月聯考化學卷(解析版) 題型:選擇題
下列關于有機物同分異構體的說法正確的是( )
A.C4H10的二氯取代物有4種
B.最簡式為C2H5的烴結構簡式有5種
C.乙苯的一氯 取代物只有3種
取代物只有3種
D.分子式為C4H10O且與鈉反應的有機物有4種
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省八校高三上學期12月聯考化學試卷(解析版) 題型:填空題
MnO2用途很廣,它是一種廣泛應用的氧化劑。例如將它加入熔態的玻璃中,可以除去帶色的雜質(硫化物或亞鐵鹽),稱為普通玻璃的“漂白劑”。在錳-鋅干電池中用作去極劑,以氧化在電極上產生的氫。
(1)Zn- MnO2干電池應用廣泛,其電解質溶液是ZnCl2-NH4Cl混合溶液。其電解質溶液呈________性(填“酸”、“堿”或“中”),原因是_________________、________________(用離子方程式表示);該電池工作時,電子流向__________極(填“正”或 “負”)。
(2)工業上,常以菱錳礦(主要成分MnCO3,常含有少量鐵、鈣、鋅等元素)為原料,用電解法可以制備MnO2。其制備過程如下:
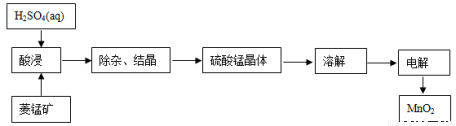
寫出酸浸的主要化學方程式:______________________。
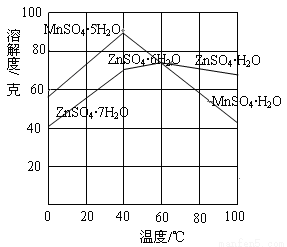
②下圖可以看出,從MnSO4和ZnSO4混合溶液中結晶MnSO4·H2O晶體,需要控制的溫度范圍為______________(填字母)。
A.0~40℃ B.40~60℃ C.60℃以上
③請寫出用惰性電極電解MnSO4溶液制備MnO2的陽極反應:___________________。
④該工藝產生的廢水中含有較多的Mn2+,通常用H2S或者Na2S溶液處理。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl氣體或加入NaOH固體以調節溶液pH,溶液pH與c(S2-)關系如圖(忽略溶液體積的變化、H2S的揮發)。
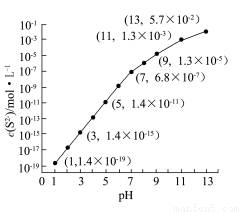
i.pH=13時,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
ii.某溶液含x mol·L-1 Mn2+、0.10 mol·L-1 H2S,當調節溶液pH=5時,Mn2+開始沉淀,則x= 。[已知:Ksp(MnS)=2.8×10-13]
查看答案和解析>>
科目:高中化學 來源:2017屆安徽省培優聯盟高三冬季聯賽化學試卷(解析版) 題型:選擇題
常溫下.用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四種金屬離子(M2+),所需S2-最低濃度的對 數值lgc(S2-)與lgc(M2+)關系如下圖所示,下列說法正確的是
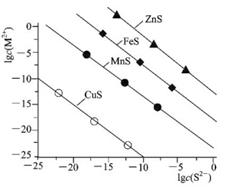
A.室溫時.向ZnS懸濁液中加人ZnSO4固體,.Ksp(ZnS)將隨之減小
B.Na2S溶液中:c(OH-)<c(H+)+c(HS-)+c(H2S)
C.為除去MnCl2溶液中混有的少量 CuCl2,可加入適量Na2S固體,充分攪拌后過濾
D.向100 mL濃度均為1×10-5mol/L的Fe2+、Zn2+混合溶液中逐滴加入1×10-4mol/LNa2S溶液,Fe2+先沉淀,證明Ksp(FeS)<Ksp(ZnS)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省分校高二上期中化學卷(解析版) 題型:選擇題
設NA為阿伏伽德羅常數的數值,下列說法正確的是( )
A.標準狀況下,22.4L二氯甲烷含有NA個二氯甲烷分子
B.1L 0.1mol/L乙酸溶液中H+數為0.1NA
C.17.6g丙烷中所含的極性共價鍵為3.2 NA個
D.1mol Na2O2 固體中含離子總數為4 NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com