
【題目】甲、乙兩燒杯中各盛有 100 mL 2 mol·L-1 的鹽酸和氫氧化鈉溶液,向兩燒杯中分別加入一定量的鋁粉,反應(yīng)結(jié)束后生成的氣體的體積比為 2:3 時(shí),加入鋁粉的質(zhì)量
A.2.7 克B.1.8 克C.4.5 克D.5.4 克
【答案】A
【解析】
由2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,酸堿足量,Al不足,生成氣體相同;金屬足量,酸堿不足,生成氣體為1:3,由鋁的質(zhì)量相同,鹽酸和氫氧化鈉溶液中溶質(zhì)的物質(zhì)的量相同,反應(yīng)結(jié)束后測(cè)得生成的氣體體積比為甲:乙=2:3,由化學(xué)反應(yīng)方程式可知,酸與金屬反應(yīng)時(shí)酸不過(guò)量,Al過(guò)量,堿與金屬反應(yīng)時(shí)堿過(guò)量,Al不足,來(lái)計(jì)算解答。
鹽酸和氫氧化鈉溶液中溶質(zhì)的物質(zhì)的量均為0.1L×2mol/L=0.2mol,又兩燒杯中分別加入等質(zhì)量的鋁粉,反應(yīng)結(jié)束后測(cè)得生成的氣體體積比為甲:乙=2:3,設(shè)鋁與酸反應(yīng)時(shí)酸完全反應(yīng),生成的氫氣的物質(zhì)的量為x,則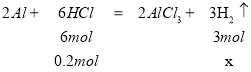 ,解得x=0.1mol,一定條件下,氣體的物質(zhì)的量之比等于體積之比,根據(jù)氣體體積比為甲:乙=2:3,則堿與金屬鋁反應(yīng)生成的氫氣的物質(zhì)的量為0.1mol×
,解得x=0.1mol,一定條件下,氣體的物質(zhì)的量之比等于體積之比,根據(jù)氣體體積比為甲:乙=2:3,則堿與金屬鋁反應(yīng)生成的氫氣的物質(zhì)的量為0.1mol×![]() =0.15mol,堿與金屬鋁反應(yīng)時(shí)鋁完全反應(yīng),設(shè)與堿反應(yīng)的鋁的物質(zhì)的量為y,則
=0.15mol,堿與金屬鋁反應(yīng)時(shí)鋁完全反應(yīng),設(shè)與堿反應(yīng)的鋁的物質(zhì)的量為y,則 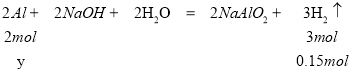 ,解得y=0.1mol,則Al的質(zhì)量為m(Al)=0.1mol×27g/mol=2.7g;答案為A。
,解得y=0.1mol,則Al的質(zhì)量為m(Al)=0.1mol×27g/mol=2.7g;答案為A。


 百分學(xué)生作業(yè)本題練王系列答案
百分學(xué)生作業(yè)本題練王系列答案 互動(dòng)課堂系列答案
互動(dòng)課堂系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
【題目】工業(yè)上冶煉鋁的原料是鋁土礦(主要成分是Al2O3,雜質(zhì)為Fe2O3、SiO2等)。某研究小組設(shè)計(jì)的提純Al2O3的方案如下:

(1)濾渣a中除含泥沙外,一定含有____,分離溶液a和濾渣a的操作需要的玻璃儀器為__________________。
(2)溶液a中含鋁元素的溶質(zhì)與過(guò)量試劑A反應(yīng)的離子方程式為_______________,溶液a與過(guò)量試劑A反應(yīng)生成濾渣b的離子方程式為__________________。
(3)溶液b與過(guò)量試劑B反應(yīng)生成濾渣c的離子方程式為_______________________。
(4)加熱濾渣c得到氧化鋁的操作需要使用的儀器除了酒精燈、三角架、泥三角,還有________(填主要儀器名稱),實(shí)驗(yàn)室里還常往NaAlO2溶液中通入過(guò)量的_______來(lái)制取A1(OH)3。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】為了測(cè)定碳酸氫鈉中雜質(zhì)氯元素(離子狀態(tài))的含量,先稱取ag試樣用蒸餾水溶解,再用足量稀硝酸酸化,配成100mL溶液,取出20mL注入錐形瓶中,然后用cmol·L-1AgNO3標(biāo)準(zhǔn)溶液滴定Cl-,K2CrO4溶液為指示劑。
已知:常溫下Ksp(AgCl)=2×10-10,Ksp(Ag2CrO4)=1.12×10-12,Ag2CrO4為磚紅色。
(1)AgNO3的水溶液呈___(填“酸”、“中”、“堿”)性,原因是(用離子方程式表示):___;
(2)當(dāng)Cl-恰好沉淀完全即溶液中殘余c(Cl-)=1.0×10-5mol·L-1,則此時(shí)溶液中的c(CrO![]() )為___mol·L-1。
)為___mol·L-1。
(3)滴定過(guò)程中,使用棕色滴定管的原因是___;
(4)當(dāng)最后一滴AgNO3滴入,___停止滴定。
(5)若此時(shí)消耗了AgNO3標(biāo)準(zhǔn)溶液VmL,則碳酸氫鈉樣品中雜質(zhì)氯元素的質(zhì)量分?jǐn)?shù)表達(dá)式為___。
(6)下列情況會(huì)造成實(shí)驗(yàn)測(cè)定結(jié)果偏低的是___。
a.盛放AgNO3溶液的滴定管水洗后未用標(biāo)準(zhǔn)液潤(rùn)洗
b.滴定管滴定前尖嘴部分有氣泡,滴定后消失
c.滴定前仰視讀數(shù),滴定后俯視讀數(shù)
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】等質(zhì)量的鎂分別在足量的二氧化碳、氧氣中燃燒,有關(guān)敘述正確的是( )
A.在二氧化碳中燃燒產(chǎn)生的固體質(zhì)量大
B.在氧氣中產(chǎn)生的氧化鎂質(zhì)量大
C.氧化劑與還原劑物質(zhì)的量之比都是2∶1
D.反應(yīng)中都是氧元素被還原
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】古代有火燒孔雀石煉銅(加入炭)和濕法煉銅(在溶液中加鐵),下列有關(guān)說(shuō)法不正確的是( )
A. 火燒孔雀石煉銅發(fā)生的反應(yīng)有Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
B. 火燒孔雀石煉銅發(fā)生的反應(yīng)有2CuO+C![]() CO2↑+2Cu
CO2↑+2Cu
C. 濕法煉銅發(fā)生的主要反應(yīng)為Fe+Cu2+===Cu+Fe2+
D. 兩種煉銅的方法涉及的主要反應(yīng)都是氧化還原反應(yīng)
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】化合物I具有貝類足絲蛋白的功能,可廣泛用于表面化學(xué)、生物醫(yī)學(xué)、海洋工程、日化用品等領(lǐng)域。其合成路線如圖:
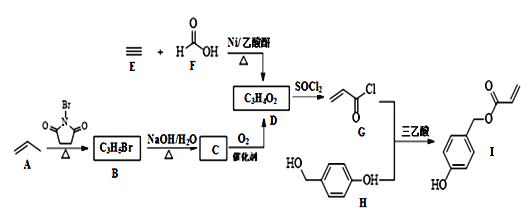
回答下列問(wèn)題:
(1)I中含氧官能團(tuán)的名稱為____。
(2)由B生成C的化學(xué)方程式為__。
(3)由E和F反應(yīng)生成D的反應(yīng)類型為____,由G和H反應(yīng)生成I的反應(yīng)類型為____。
(4)僅以D為單體合成高分子化合物的化學(xué)方程式為___。
(5)X是I的芳香同分異構(gòu)體,能發(fā)生銀鏡反應(yīng),能與飽和碳酸氫鈉溶液反應(yīng)放出CO2,其核磁共振氫譜顯示有4種不同化學(xué)環(huán)境的氫,峰面積比為6∶2∶1∶1。寫(xiě)出兩種符合要求的X的結(jié)構(gòu)簡(jiǎn)式___。
(6)參照本題信息,試寫(xiě)出以1丁烯為原料制取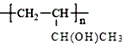 的合成路線流程圖(無(wú)機(jī)原料任選)___。
的合成路線流程圖(無(wú)機(jī)原料任選)___。
合成路線流程圖示例如圖:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】碳、氮是中學(xué)化學(xué)重要的非金屬元素,在生產(chǎn)、生活中有廣泛的應(yīng)用。
(1)治理汽車尾氣中NO和CO的一種方法是:在汽車的排氣管道上安裝一個(gè)催化轉(zhuǎn)化裝置,使NO與CO反應(yīng),產(chǎn)物都是空氣中的主要成分。寫(xiě)出該反應(yīng)的熱化學(xué)方程式___。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol
(2)己知植物光合作用發(fā)生的反應(yīng)如下:
6CO2(g)+6H2O(l)![]() C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
該反應(yīng)達(dá)到化學(xué)平衡后,若改變下列條件,CO2轉(zhuǎn)化率增大的是___。
a.增大CO2的濃度 b.取走一半C6H12O6 c.加入催化劑 d.適當(dāng)升高溫度
(3)N2O5的分解反應(yīng)2N2O5(g)![]() 4NO2(g)+O2(g),由實(shí)驗(yàn)測(cè)得在67℃時(shí)N2O5的濃度隨時(shí)間的變化如下:
4NO2(g)+O2(g),由實(shí)驗(yàn)測(cè)得在67℃時(shí)N2O5的濃度隨時(shí)間的變化如下:
時(shí)間/min | 0 | 1 | 2 | 3 | 4 | 5 |
C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
計(jì)算在0~2min時(shí)段,化學(xué)反應(yīng)速率v(NO2)=___molL-1min-1。
(4)新的研究表明,可以將CO2轉(zhuǎn)化為炭黑進(jìn)行回收利用,反應(yīng)原理如圖所示。
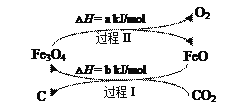
①在轉(zhuǎn)化過(guò)程中起催化作用的物質(zhì)是___;
②寫(xiě)出總反應(yīng)的化學(xué)方程式___。
(5)工業(yè)上以NH3和CO2為原料合成尿素[CO(NH2)2),反應(yīng)的化學(xué)方程式如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根據(jù)上述反應(yīng),填寫(xiě)下列空白
①己知該反應(yīng)可以自發(fā)進(jìn)行,則△
②一定溫度和壓強(qiáng)下,若原料氣中的NH3和CO2的物質(zhì)的量之比![]() =x,如圖是x與CO2的平衡轉(zhuǎn)化率(α)的關(guān)系。α隨著x增大而增大的原因是___;B點(diǎn)處,NH3的平衡轉(zhuǎn)化率為___。
=x,如圖是x與CO2的平衡轉(zhuǎn)化率(α)的關(guān)系。α隨著x增大而增大的原因是___;B點(diǎn)處,NH3的平衡轉(zhuǎn)化率為___。
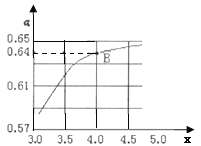
③一定溫度下,在3L定容密閉容器中充入NH3和CO2,若x=2,當(dāng)反應(yīng)后氣體壓強(qiáng)變?yōu)槠鹗紩r(shí)氣體壓強(qiáng)的![]() 時(shí)達(dá)到平衡,測(cè)得此時(shí)生成尿素90g。該反應(yīng)的平衡常數(shù)K=___。
時(shí)達(dá)到平衡,測(cè)得此時(shí)生成尿素90g。該反應(yīng)的平衡常數(shù)K=___。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】硒是典型的半導(dǎo)體材料,在光照射下導(dǎo)電性可提高近千倍。圖1是從某工廠的硒化銀半導(dǎo)體廢料(含Ag2Se、Cu單質(zhì))中提取硒、銀的工藝流程圖:
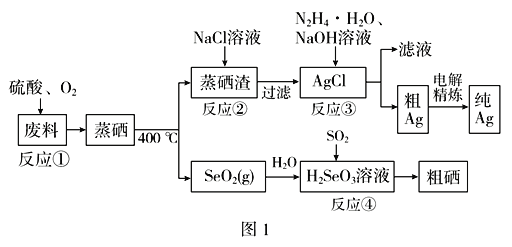
(1)為提高反應(yīng)①的浸出速率,可采取的措施為______________(答出兩條)。
(2)已知反應(yīng)③生成一種可參與大氣循環(huán)的氣體單質(zhì),寫(xiě)出該反應(yīng)的離子方程式__________。
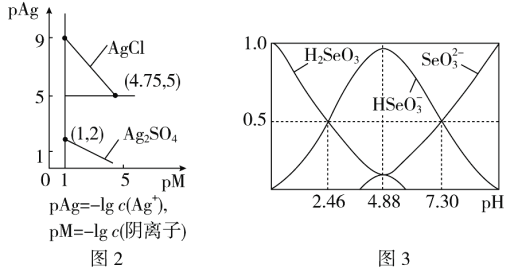
(3)反應(yīng)②為Ag2SO4(s)+2Cl-(aq)![]() 2AgCl(s)+
2AgCl(s)+![]() (aq);常溫下,Ag2SO4、AgCl的飽和溶液中陽(yáng)離子和陰離子濃度關(guān)系如圖2所示。則Ag2SO4(s)+2Cl-(aq)
(aq);常溫下,Ag2SO4、AgCl的飽和溶液中陽(yáng)離子和陰離子濃度關(guān)系如圖2所示。則Ag2SO4(s)+2Cl-(aq) ![]() 2AgCl(s)+
2AgCl(s)+![]() (aq)的化學(xué)平衡常數(shù)的數(shù)量級(jí)為________。
(aq)的化學(xué)平衡常數(shù)的數(shù)量級(jí)為________。
(4)寫(xiě)出反應(yīng)④的化學(xué)方程式________________________________________。
(5)室溫下,H2SeO3水溶液中H2SeO3、![]() 、
、![]() 的物質(zhì)的量分?jǐn)?shù)隨pH的變化如圖3所示,則室溫下H2SeO3的Ka2=________。
的物質(zhì)的量分?jǐn)?shù)隨pH的變化如圖3所示,則室溫下H2SeO3的Ka2=________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】下列反應(yīng)能通過(guò)原電池的形式來(lái)實(shí)現(xiàn)的是
A.Cu+2Ag+=2Ag+Cu2+B.Cu+2H+=H2↑+Cu2+
C.CaCO3+2HCl=CaCl2+CO2↑十H2OD.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com