
【題目】對金屬鋅與濃硫酸的反應來說,下列說法不當的是( )
A.若金屬鋅足量,反應所放出的氣體應為混合物
B.反應消耗的鋅的物質的量一定等于反應生成的氣體的物質的量
C.反應中所轉移的電子的物質的量一定等于反應生成的氣體的物質的量2倍
D.由于金屬鋁的活動性強于鋅,所以鋁與濃硫酸的反應一定比鋅與濃硫酸反應劇烈
 經典密卷系列答案
經典密卷系列答案 金牌課堂練系列答案
金牌課堂練系列答案 三新快車金牌周周練系列答案
三新快車金牌周周練系列答案科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示。已知YW的原子充數之和是Z的3倍,下列說法正確的是( )

A.原子半徑:X<Y<Z
B.氣態氫化物的穩定性:X>Z
C.Z、W均可與Mg形成離子化合物
D.最高價氧化物對應水化物的酸性:Y>W
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在以離子鍵為主的化學鍵中常含有共價鍵的成分.下列各對原子形成化學鍵中共價鍵成分最少的是( )
A. Na,F B. Al,O C. Li,Cl D. Mg,S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是常規核裂變產物之一,可以通過測定大氣或水中
是常規核裂變產物之一,可以通過測定大氣或水中![]() 的含量變化來監測核電站是否發生放射性物質泄漏。下列有關
的含量變化來監測核電站是否發生放射性物質泄漏。下列有關![]() 的敘述中錯誤的是
的敘述中錯誤的是
A. ![]() 的化學性質與
的化學性質與![]() 相同 B.
相同 B. ![]() 的原子序數為53
的原子序數為53
C. ![]() 的原子核外電子數為78 D.
的原子核外電子數為78 D. ![]() 的原子核內中子數多于質子數
的原子核內中子數多于質子數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨是人類科學技術上的一項重大突破,其反應原理為:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
一種工業合成氨的簡易流程圖如下:
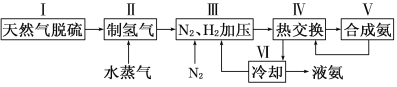
(1)在密閉容器中,使2 mol N2和6 mol H2混合發生下列反應:N2(g)+3H2(g)![]() 2NH3(g)(正反應為放熱反應)當反應達到平衡時,N2和H2的濃度比是 。升高平衡體系的溫度(保持體積不變),該反應 (填“逆向移動”正向移動”或“不移動”) 。
2NH3(g)(正反應為放熱反應)當反應達到平衡時,N2和H2的濃度比是 。升高平衡體系的溫度(保持體積不變),該反應 (填“逆向移動”正向移動”或“不移動”) 。
(2)氨水、氯水中均存在多種微粒和多個平衡,請寫出氯水中存在的一個化學平衡反應的離子方程式 。
(3)步驟Ⅱ中制氫氣原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
對于反應①,一定可以提高平衡體系中H2百分含量,又能加快反應速率的措施是___________。
a.升高溫度 b.增大壓強
c.加入催化劑 d.降低壓強
利用反應②,將CO進一步轉化,可提高H2產量。若2 mol CO和H2的混合氣體(H2的體積分數為80%)與H2O反應,得到2.28mol CO、CO2和H2的混合氣體,則CO轉化率為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在鈉與水反應的實驗操作中,符合化學實驗安全規則的是
A. 不經切割,直接用大塊的鈉做實驗 B. 用手小心抓住鈉塊投入燒杯中
C. 在燒杯口蓋上玻片后再觀察現象 D. 將剩余的鈉塊放入廢液缸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.標準狀況下,1L 1mol/LHF溶液中含HF分子數目為NA
B.2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,將2mol CO2和6mol H2在一密閉容器中按照上述反應充分反應放出a kJ的熱量
CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,將2mol CO2和6mol H2在一密閉容器中按照上述反應充分反應放出a kJ的熱量
C.78gNa2O2固體中含陰離子數目為NA
D.25g質量分數68%的H2O2水溶液中含氧原子數目為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列曲線分別表示元素的某種性質與核電荷數的關系(Z為核電荷數,Y為元素有關性質);

把與下面的元素有關性質相符的曲線的標號填入相應括號中:
(1) IIA族元素的價電子數(______) (2)ⅦA族元素氫化物的沸點(______)
(3)第三周期元素單質的熔點(______) (4)第三周期元素的最高正化合價(______)
(5) lA族元素單質熔點(______) (6) F-、Na+、Mg2+、Al3+四種離子的離子半徑(______)
(7)短周期元素的原子半徑(______)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com