
| A. | 用Y 表示的化學反應速率為0.005 mol/(L•s) | |
| B. | 將容器體積變為20 L,Z的平衡濃度變為原來的$\frac{1}{2}$ | |
| C. | 若升高溫度Y的轉化率減小,則正反應為放熱反應 | |
| D. | 達到平衡時,Y與Z的濃度相等 |
分析 A.結合v=$\frac{△c}{△t}$及速率之比等于化學計量數之比計算;
B.該反應為氣體體積縮小的反應,將容器體積變為20 L,平衡逆向移動;
C.若升高溫度Y的轉化率減小,可知升高溫度,平衡逆向移動;
D.起始濃度未知,不能確定平衡時Y的濃度.
解答 解:A.v(Z)=$\frac{△c}{△t}$=$\frac{\frac{0.3mol}{10L}}{60s}$=0.0005mol/(L•s),由速率之比等于化學計量數之比可知,用Y 表示的化學反應速率為0.0005 mol/(L•s),故A錯誤;
B.該反應為氣體體積縮小的反應,將容器體積變為20 L,平衡逆向移動,則Z的平衡濃度小于原來的$\frac{1}{2}$,故B錯誤;
C.若升高溫度Y的轉化率減小,可知升高溫度,平衡逆向移動,則正反應為放熱反應,故C正確;
D.起始濃度未知,不能確定平衡時Y的濃度,則達到平衡時,不能判斷Y與Z的濃度關系,故D錯誤;
故選C.
點評 本題考查化學平衡的計算,為高頻考點,把握速率的計算、壓強、溫度對平衡移動的影響為解答的關鍵,側重分析與應用能力的綜合考查,注意起始濃度未知,題目難度不大.


科目:高中化學 來源: 題型:解答題
 2012年世界青年奧運會將在南京舉辦.保護環境,人人有責.
2012年世界青年奧運會將在南京舉辦.保護環境,人人有責.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蒸餾過程中發現未加沸石,應立即補加沸石 | |
| B. | 分液過程中先將下次液體分出,稍等片刻后再分出上層液體 | |
| C. | 海水提溴即用有機溶劑中海水中萃取溴 | |
| D. | 除去NaCl少量KNO3,可先配成飽和溶液,然后蒸發結晶、趁熱過濾 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5min內D的平均反應速率是0.2mol/(L•min) | |
| B. | 3υA=2υD | |
| C. | x的值是2 | |
| D. | A的起始物質的量為1.5mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
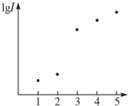 電離能是指從氣態原子在基態時失去電子成為陽離子所吸收的能量,如圖表示元素X的前五級電離能的對數值,試推測X可能是哪些元素( )
電離能是指從氣態原子在基態時失去電子成為陽離子所吸收的能量,如圖表示元素X的前五級電離能的對數值,試推測X可能是哪些元素( )| A. | 第ⅠA族 | B. | 第ⅡA族 | C. | 第ⅢA族 | D. | 第ⅣA族 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
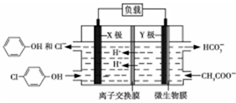 測得某工業廢水中含有乙酸鈉及對氯酚(
測得某工業廢水中含有乙酸鈉及對氯酚(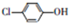 ),為改善水質現利用微生物電池加以去除,反應原理如圖所示,下列說法正確的是( )
),為改善水質現利用微生物電池加以去除,反應原理如圖所示,下列說法正確的是( )| A. | X極為微生物電池的負極 | |
| B. | 該電池能夠在高溫下工作 | |
| C. | 圖中離子交換膜應為陰離子交換膜 | |
| D. | Y極電極反應式為:CH3COO--8e-+4H2O═2HCO3-+9H+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com