
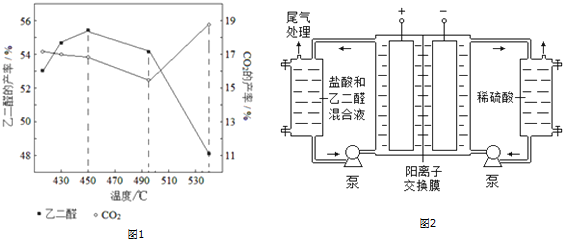
分析 (1)催化劑是硝酸銅、反應物是乙醛和稀硝酸,生成物是乙二醛、NO和水,根據反應式和生成物書寫方程式;
該反應中需要具有腐蝕性是酸,且生成有毒氣體NO;
(2)①OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
將第二個方程式減去第一個方程式得HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),△H進行相應的改變,方程式相減其平衡常數相除;
②溫度升高,平衡向吸熱方向移動,溫度大于495℃二氧化碳產率增大;
(3)該電解池中,陽極上氯離子放電生成氯氣,陰極上氫離子放電生成氫氣;
(4)增強溶液導電性.
解答 解:(1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被還原為NO,反應方程式為:3CH3CHO+4HNO3$\frac{\underline{\;Cu(NO_{3})_{2}\;}}{\;}$3OHC-CHO+4NO↑+5H2O,存在比較明顯的缺點是:生成的NO會污染空氣,硝酸會腐蝕設備,
故答案為:3CH3CHO+4HNO3$\frac{\underline{\;Cu(NO_{3})_{2}\;}}{\;}$3OHC-CHO+4NO↑+5H2O;生成的NO會污染空氣,硝酸會腐蝕設備;
(2)①-OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
將第二個方程式減去第一個方程式得HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),△H=(-484kJ•mol-1 )-(-78kJ•mol-1 )=-406kJ/mol,化學平衡常數K=$\frac{{K}_{2}}{{K}_{1}}$,
故答案為:-406;$\frac{{K}_{2}}{{K}_{1}}$;
②主反應HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g)為放熱反應,升高溫度平衡逆向移動;溫度超過495℃時,乙二醇大量轉化為二氧化碳等副產物,使乙二醛產率降低,
故答案為:升高溫度,主反應平衡逆向移動;溫度超過495℃時,乙二醇大量轉化為二氧化碳等副產物;
(3)陰極上氫離子放電生成氫氣,電極反應式為2H++2e-=H2↑,故答案為:2H++2e-=H2↑;
(4)乙醛的水溶液導電性較弱,為了增強溶液導電性且生成氯氣,所以加入稀鹽酸,
故答案為:增強導電性.
點評 本題考查電解原理、氧化還原反應、蓋斯定律、外界條件對化學平衡影響等知識點,側重考查學生圖象分析判斷及計算能力,難點是電極反應式的書寫,注意:化學方程式相加時化學平衡常數相乘,方程式相減時平衡常數相除,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 先加入BaCl2溶液,產生了白色沉淀,再加入足量的HCl溶液,沉淀不溶解,溶液中一定含有大量SO${\;}_{4}^{2-}$ | |
| B. | 加入足量的CaCl2溶液,產生了白色沉淀,加入鹽酸可以產生無色且能使澄清石灰水變渾濁的氣體,則該溶液不一定含有大量的CO${\;}_{3}^{2-}$ | |
| C. | 加入足量濃 NaOH溶液加熱,產生了帶有強烈刺激性氣味的能使濕潤的紅色石蕊試紙變藍的氣體,溶液中一定含有大量的NH${\;}_{4}^{+}$ | |
| D. | 先加適量的硝酸將溶液酸化,再加AgNO3溶液,產生了白色沉淀.溶液中一定含有大量的Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 25℃時,0.1mol•L-1HF 溶液中pH=1 | |
| B. | Ksp(CaF2)隨溫度和濃度的變化而變化 | |
| C. | 加入CaCl2溶液后體系中的c(H+)不變 | |
| D. | 該體系中HF與CaCl2反應產生沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
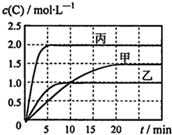 向甲、乙、丙三個密閉容器中充入一定量的A和B,發生反應:A(g)+хB(g)?2C(g).各容器的反應溫度、反應物起始量,反應過程中物質C的濃度隨時間變化關系分別用表和圖表示:
向甲、乙、丙三個密閉容器中充入一定量的A和B,發生反應:A(g)+хB(g)?2C(g).各容器的反應溫度、反應物起始量,反應過程中物質C的濃度隨時間變化關系分別用表和圖表示:| 容器 | 甲 | 乙 | 丙 |
| 容積 | 0.5L | 0.5L | 1.0L |
| 溫度/℃ | T1 | T2 | T3 |
| 反應物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 達平衡時A(g)的濃度:乙=丙>甲 | |
| B. | 甲容器中達平衡時B(g)的轉化率為75% | |
| C. | 溫度分別為T1、T2時,該反應的平衡常數:K(T1)<K(T2) | |
| D. | 丙容器中達到平衡后,若同時向容器中再充入1mol A(g)、1mol B(g)、1molC(g),則平衡向逆反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com