
元素周期表第ⅤA族元素包括氮、磷、砷(As)、銻(Sb)等。這些元素無論在研制新型材料,還是在制作傳統化肥、農藥等方面都發揮了重要的作用。請回答下列問題:
(1)N4分子是一種不穩定的多氮分子,這種物質分解后能產生無毒的氮氣并釋放出大量能量,能被應用于制造推進劑或炸藥。N4是由四個氮原子組成的氮單質,其中氮原子采用的軌道雜化方式為sp3,該分子的空間構型為________,N—N鍵的鍵角為________。
(2)基態砷原子的最外層電子排布式為________。
(3)電負性是用來表示兩個不同原子形成化學鍵時吸引鍵合電子能力的相對強弱,是元素的原子在分子中吸引共用電子對的能力。由此判斷N、P、As、Sb的電負性從大到小的順序是______________。
(4)聯氨(N2H4)可以表示為H2N—NH2,其中氮原子采用的軌道雜化方式為________,聯氨的堿性比氨的堿性________(填“強”或“弱”),其原因是________________________________________________________________。
寫出N2H4與N2O4反應的化學方程式:____________________。
(5)元素X與N同周期,且X的原子半徑是該周期主族元素原子半徑中最小的,X與Ca形成的化合物CaX2的晶胞結構如圖所示:
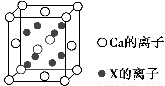
CaX2的晶體類型是________,一個晶胞中含有Ca的離子數為________,含有X的離子數為________。
(1)正四面體 60° (2)4s24p3
(3)N>P>As>Sb
(4)sp3 弱 N2H4中的N原子上電子云密度小于NH3,更難結合H+ 2N2H4+N2O4=3N2+4H2O
(5)離子晶體 4 8
【解析】(1)N4中氮原子的軌道雜化方式為sp3,其空間構型可參照P4(白磷),應為正四面體結構,N—N鍵的鍵角為60°;(2)砷位于第四周期ⅤA族,其最外層電子排布式為4s24p3;(3)同主族元素從上到下,元素的電負性逐漸減小;(4)聯氨(HN2—NH2)中氮原子與其他原子結合形成三個σ鍵,還有一對孤電子對,其軌道雜化方式為sp3;與NH3相比,N2H4堿性弱,因為N2H4相當于NH3的一個H原子換成了—NH2,N原子的吸電子能力遠強于H原子,因此N2H4中的N原子上電子云密度小于NH3,更難結合H+;(5)N元素位于第二周期,該周期中原子半徑最小的主族元素為F,CaF2為離子晶體,該晶胞中Ca2+的個數為8×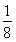 +6×
+6×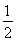 =4,F-均在晶胞內部,故為8個。
=4,F-均在晶胞內部,故為8個。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2014年高中化學二輪創新訓練上 專題7電解質溶液練習卷(解析版) 題型:填空題
某二元酸(化學式用H2B表示)在水中的電離方程式是H2B=H++HB-;HB-??H++B2-。回答下列問題。
(1)Na2B溶液顯________(填“酸性”、“中性”或“堿性”),理由是________________(用離子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子濃度關系式正確的是________。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,則0.1 mol·L-1 H2B溶液中的氫離子的物質的量濃度可能________0.11 mol·L-1(填“<”、“>”或“=”),理由是_________________________________________________________________。
(4)0.1 mol·L-1 NaHB溶液中各種離子濃度由大到小的順序是_____________。
查看答案和解析>>
科目:高中化學 來源:2014年高中化學二輪創新訓練上 專題3常見的兩種重要反應類型練習卷(解析版) 題型:填空題
(1)請將下列五種物質:KBr、Br2、I2、KI、K2SO4分別填入下列橫線上,組成一個未配平的化學方程式:
KBrO3+________+H2SO4―→________+________+________+________+H2O。
(2)如果該化學方程式中I2和KBr的化學計量數分別是8和1,則
①Br2的化學計量數是________;
②請將反應物的化學式及配平后的化學計量數填入下列相應的位置中:
________KBrO3+________+________H2SO4―→……;
③若轉移10 mol電子,則反應后生成I2的物質的量為________。
查看答案和解析>>
科目:高中化學 來源:2014年高中化學二輪創新訓練上 專題2常用化學計量-物質的量練習卷(解析版) 題型:選擇題
物質的量為0.10 mol的鎂條在只含有CO2和O2混合氣體的容器中燃燒(產物不含碳酸鎂),反應后容器內固體物質的質量不可能為( )。
A.3.2 g B.4.0 g C.4.2 g D.4.6 g
查看答案和解析>>
科目:高中化學 來源:2014年高中化學二輪創新訓練上 專題15有機化學基礎選考練習卷(解析版) 題型:填空題
共軛雙烯與含有雙鍵的化合物相互作用,能生成六元環狀化合物,常用于有機合成,例如:
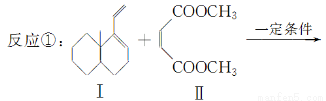
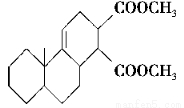
化合物Ⅱ可發生以下反應:
Ⅱ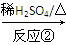 Ⅲ(分子式為C4H4O4)
Ⅲ(分子式為C4H4O4) 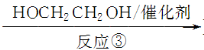 Ⅳ(高分子化合物)
Ⅳ(高分子化合物)
(1)化合物I的分子式為________,1 mol該物質完全燃燒需消耗________mol O2。
(2)反應②的化學方程式為__________________________________________。
(3)反應③是縮聚反應,化合物Ⅳ的結構簡式為________。
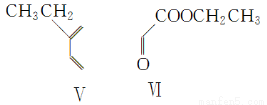
(4)在一定條件下,化合物Ⅴ和化合物Ⅵ能發生類似反應①的反應,生成兩種化合物(互為同分異構體),這兩種化合物的結構簡式分別為________、________。
(5)下列關于化合物Ⅰ、Ⅱ、Ⅴ、Ⅵ的說法正確的有________(填字母)。
A.Ⅰ屬于芳香烴
B.Ⅰ、Ⅱ、Ⅴ均能使溴的四氯化碳溶液褪色
C.Ⅴ與足量H2加成后的產物是3-甲基戊烷
D.加熱條件下Ⅵ能與新制Cu(OH)2反應生成紅色沉淀
查看答案和解析>>
科目:高中化學 來源:2014年高中化學二輪創新訓練上 專題14物質結構與性質選考練習卷(解析版) 題型:填空題
鉀、鎂、氟、硼等元素在每升海水中的含量都大于1毫克,屬于海水中的常量元素。
(1)鉀、鎂、氟、硼電負性從大到小的排列順序是__________________________。
(2)鎵與硼同主族,寫出鎵元素原子的價電子排布式(即外圍電子排布式):________________。
(3)用價層電子對互斥模型推斷BF3和NF3的空間構型分別為________、________。
(4)鉀、鎂、氟形成的某化合物的晶體結構為K+在立方晶胞的中心,Mg2+在晶胞的8個頂角,F-處于晶胞的棱邊中心。由鉀、鎂、氟形成的該化合物的化學式為________,每個K+與________個F-配位。
查看答案和解析>>
科目:高中化學 來源:2014年高中化學二輪創新訓練上 專題13化學實驗綜合應用練習卷(解析版) 題型:實驗題
硫酸銅受熱分解生成氧化銅和氣體,加熱溫度不同,氣體成分也不同。氣體成分可能含SO2、SO3和O2中的一種、兩種或三種。某化學課外活動小組通過設計探究性實驗,測定反應產生的SO2、SO3和O2的物質的量,并計算確定各物質的化學計量數,從而確定CuSO4分解的化學方程式。實驗用到的儀器如下圖所示:
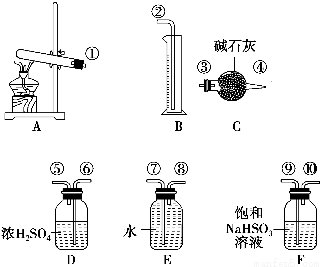
[提出猜想]
Ⅰ.所得氣體的成分可能只含SO3一種;
Ⅱ.所得氣體的成分可能含有________兩種;
Ⅲ.所得氣體的成分可能含有________三種。
[實驗探究]
實驗操作過程略。已知實驗結束時,硫酸銅完全分解。
(1)請你組裝探究實驗的裝置,按從左至右的方向,各儀器接口的連接順序為①→⑨→⑩→⑥→⑤→________→________→________→________→②(填接口序號)。
(2)若實驗結束時B中量筒沒有收集到水,則證明猜想________正確。
(3)有兩個實驗小組進行該實驗,由于加熱時的溫度不同,實驗結束后測得相關數據也不同,數據如下:
實驗 小組 | 稱取CuSO4 的質量/g | 裝置C增加 的質量/g | 量筒中水的體積折算成標準狀況下氣體的體積/mL |
一 | 6.4 | 2.56 | 448 |
二 | 6.4 | 2.56 | 224 |
請通過計算,推斷出第一小組和第二小組的實驗條件下CuSO4分解的化學方程式。
第一小組:________________________________________________________;
第二小組:________________________________________________________。
查看答案和解析>>
科目:高中化學 來源:2014年高中化學二輪創新訓練上 專題11常見有機化合物及其應用練習卷(解析版) 題型:選擇題
25 ℃和101 kPa時,乙烷、乙炔和丙烯組成的混合烴32 mL與過量氧氣混合并完全燃燒,除去水蒸氣,恢復到原來的溫度和壓強,氣體總體積縮小了72 mL,原混合烴中乙炔的體積分數為 ( )。
A.12.5% B.25% C.50% D.75%
查看答案和解析>>
科目:高中化學 來源:2014年高一化學人教版必修二 4-2資源綜合利用、環境保護練習卷(解析版) 題型:選擇題
國家游泳中心(俗稱“水立方”)采用了高分子膜材料“ETFE”,該材料是四氟乙烯(CF2=CF2)與乙烯(CH2=CH2)發生聚合反應得到的高分子材料。下列說法不正確的是( )
A.“ETFE”分子中可能存在“—CH2—CH2—CF2—CF2—”的連接方式
B.合成“ETFE”的反應為加聚反應
C.CF2=CF2和CH2=CH2均是平面形分子
D.CF2=CF2可由CH3CH3與F2兩種物質直接反應制得
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com