
分析 (1)根據AgBr+2S2O32-?[Ag(S2O3)2]3-+Br-,結合Ksp(AgBr)、-[Ag(S2O3)2]3-的平衡常數解答;
(2)硫化鈉為強電解質完全電離,電離出的硫離子和硫代硫酸銀反應生成硫化銀沉淀,硫化銀溶解在熱的鹽酸中,鐵的金屬性強于銀,將銀置換出,硫化氫有毒,據此分析解答;
(3)根據電解原理分析判斷,陽極上金屬或陰離子失電子發生氧化反應,陰極上陽離子得電子變成單質在陰極析出,用電解的方法從廢定影液中回收銀,陰極為銀離子得到電子.
解答 解:(1)設AgBr在1L1.00mol/LNa2S2O3溶液中溶解的物質的量為x,AgBr+2S2O32-?[Ag(S2O3)2]3-+Br-,則與硫代硫酸根離子結合的銀離子為x,溶液中的溴離子為x,Ksp(AgBr)=a,Ksp(AgBr)=c(Ag+)•c(Br-)=a,與硫代硫酸根離子結合的c(Ag+)=$\sqrt{a}$-x,Ag++2S2O32-?[Ag(S2O3)2]3-的平衡常數K=b,$\frac{C[Ag({S}_{2}{O}_{3})_{2}]^{3-}}{C(A{g}^{+})×{C}^{2}({S}_{2}{{O}_{3}}^{2-})}$=b,1L1.00mol/LNa2S2O3溶液中C(S2O32-)=1.00mol/L,則$\frac{x}{(\sqrt{a}-x)×(0.1-2x)^{2}}$=b,解得:x≈$\frac{\sqrt{ab}}{1+2\sqrt{ab}}$,AgBr摩爾質量為188g/mol,則在1L1.00mol/LNa2S2O3溶液中溶解的質量為:$\frac{188\sqrt{ab}}{1+2\sqrt{ab}}$,
故答案為:$\frac{188\sqrt{ab}}{1+2\sqrt{ab}}$;
(2)硫化鈉為強電解質完全電離,Na2S=2Na++S2-,硫離子和硫代硫酸銀反應生成硫化銀沉淀,2[Ag(S2O3)2]3-+S2-=Ag2S↓+4S2O32-,再把硫化銀沉淀為加入熱的鹽酸中,鐵的金屬性強于銀,將銀置換出,硫化氫有毒,該操作需在通風廚中進行,
故答案為:2[Ag(S2O3)2]3-+S2-=Ag2S↓+4S2O32-;通風廚;
(3)電解池:陰極上陽離子得電子變成單質在陰極析出,用電解的方法從廢定影液中回收銀,陰極用銀棒,在銀棒上析出銀,回收銀Ag++e-=Ag,從廢定影液中回收銀,陽極無需用銀棒,用A.石墨棒即可,
故答案為:A;B;Ag++e-=Ag.
點評 本題考查了沉淀溶解平衡計算、電解池原理的分析應用,為高頻考點,側重于學生的計算能力和分析能力的考查,注意把握溶度積的計算以及電解產物的分析判斷,掌握基礎是關鍵,題目難度中等.


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:選擇題
| A. | 干冰、鐵、氯化氫 | B. | 空氣、液氨、膽礬 | ||
| C. | 冰水混合物、燒堿、氯化鈉 | D. | 鹽酸、氧化鐵、二氧化硫 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的摩爾質量就是1mol物質的質量 | |
| B. | 1mol水的質量、水的摩爾質量和水的相對分子質量在數值上都是18 | |
| C. | 各種物質的摩爾質量不可能相同 | |
| D. | 與物質的質量、物質的量多少無關,但與相對分子質量一樣都是物質的基本屬性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
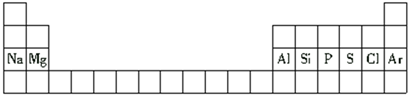
| A. | 鋁是第二周期元素 | |
| B. | 氯原子的半徑比硫原子的半徑小 | |
| C. | 氫氧化鈉的堿性比氫氧化鎂的堿性弱 | |
| D. | 硅原子的最外層電子數比磷原子的最外層電子數多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
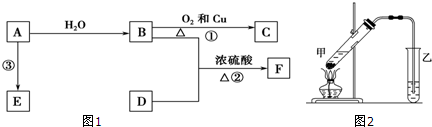
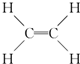 ,B中決定性質的重要官能團的名稱為羥基.
,B中決定性質的重要官能團的名稱為羥基.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
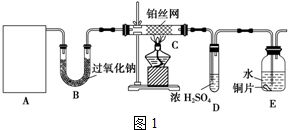
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | c (Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | B. | c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | ||
| C. | c (Na+)>c(HA-)>c(OH-)>c(A2-)>c(H+) | D. | c(Na+)=c(HA-)+c(HA)+2c(A2-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com