
【題目】環戊烯是生產精細化工產品的重要中間體,其制備涉及的反應如下:
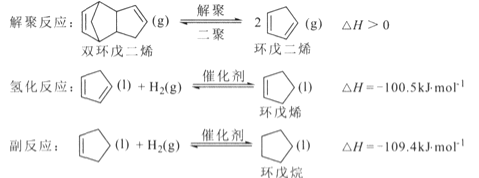
回答下列問題:
(l)反應![]() 的△H= _________ kJ/mol 。
的△H= _________ kJ/mol 。
(2)解聚反應在剛性容器中進行。
①其他條件不變,有利于提高雙環戊二烯平衡轉化率的條件是 ____ (填標號).
A.升高溫度 B.降低溫度 C.增大壓強 D.減小壓強
②實際生產中常通入水蒸氣以降低雙環戊二烯的沸點。某溫度下,通入總壓為l00kPa的雙環戊二烯和水蒸氣,達到平衡后總壓為160kPa,雙環戊二烯的轉化率為8 0%,則 pH2O=___kpa,平衡常數Kp=______kPa (Kp為以分壓表示的平衡常數)
(3) 一定條件下,將環戊二烯溶于有機溶劑中進行氫化反應,反應過程中保持氫氣壓力不變,測得環戊烯和環戊烷的產率(以環戊二烯為原料計)隨時間變化如下圖所示。

①將環戊二烯溶于有機溶劑中可減少二聚反應的發生,原因是____,
②最佳的反應時間為__h。活化能較大的是__(填“氫化反應”或“副反應”)。
(4)已知氫化反應平衡常數為1.6 × 1012,副反應的平衡常數為2.0×10l2。在恒溫恒容下,環戊二烯與氫氣按物質的量之比為1:1進行反應,則環戊二烯的含量隨時間變化趨勢是____(不考慮環戊二烯的二聚反應)。
【答案】-209.9 AD 25 960 降低環戊二烯濃度,減小二聚速率;稀釋有利于平衡向解聚方向移動 4 副反應 先變小后變大(最后不變)
【解析】
(1)已知![]() ,
,
![]() ,根據蓋斯定律,由氫化反應+副反應得反應
,根據蓋斯定律,由氫化反應+副反應得反應![]() △H=-100.5kJ/mol-109.4kJ/mol=-209.9kJ/mol;
△H=-100.5kJ/mol-109.4kJ/mol=-209.9kJ/mol;
(2)①提高雙環戊二烯平衡轉化率則平衡正向移動;
A.升高溫度,平衡向吸熱反應的正反應方向移動,選項A符合;
B.降低溫度,平衡向放熱反應的逆反應方向移動,選項B不符合;
C.增大壓強,平衡向氣體體積縮小的逆反應方向移動,選項C不符合;
D.減小壓強,平衡向氣體體積增大的正反應方向移動,選項D符合;
答案選AD;
②實際生產中常通入水蒸氣以降低雙環戊二烯的沸點。某溫度下,通入總壓為l00kPa的雙環戊二烯和水蒸氣,達到平衡后總壓為160kPa,則增壓60kPa,雙環戊二烯的轉化率為8 0%,則反應前雙環戊二烯的分壓為![]() ,則 pH2O=l00kPa-75kPa=25kPa,平衡時雙環戊二烯、環戊二烯的平衡分壓分別為15kPa、120kPa,平衡常數Kp=
,則 pH2O=l00kPa-75kPa=25kPa,平衡時雙環戊二烯、環戊二烯的平衡分壓分別為15kPa、120kPa,平衡常數Kp=![]() =960kPa;
=960kPa;
(3)①將環戊二烯溶于有機溶劑中可減少二聚反應的發生,原因是降低環戊二烯濃度,減小二聚速率;稀釋有利于平衡向解聚方向移動;
②根據圖中信息可知,4h時環戊烯的產率最大,故最佳的反應時間為4h。根據各反應的焓變以及環戊烯和環戊烷產率隨時間的變化曲線可知,活化能較大的是副反應;
(4)已知氫化反應平衡常數為1.6 ×1012,副反應的平衡常數為2.0×1012。在恒溫恒容下,環戊二烯與氫氣按物質的量之比為1:1進行反應,開始一段時間,氫化反應的活化能較小,氫化反應比副反應快,環戊二烯的含量隨時間的推移變小;一段時間后,由于副反應的平衡常數大于氫化反應的平衡常數,副反應進行的程度大、放熱多,使氫化反應逆向進行,環戊二烯的含量隨時間推移又變大,直至最后不變。


科目:高中化學 來源: 題型:
【題目】金屬蝕刻加工過程中,常用鹽酸對其表面氧化物進行清洗,會產生酸洗廢水。 pH在1.5左右的某酸洗廢水中含鐵元素質量分數約3%,其他金屬元素如銅、鎳、鋅、 鉻濃度較低,工業上綜合利用酸洗廢水可制備三氯化鐵。制備過程如下:

相關金屬離子生成氫氧化物沉淀的pH如下表所示:

回答下列問題:
(1)“中和”時發生反應的化學方程式為__________________,調節pH至________范圍,有利于后續制備得純度較高的產品。
(2)酸溶處理中和后的濾渣,使鐵元素浸出。濾渣和工業鹽酸反應時,不同反應溫度下 鐵浸出率隨時間變化如圖(a)所示,可知酸溶的最佳溫度為_______________。按照不同的固液比(濾渣和工業鹽酸的投入體積比)進行反應時,鐵浸出率隨時間變化如 圖(b)所示,實際生產中固液比選擇1.5:1的原因是___________。

(3)氧化時,可選氯酸鈉或過氧化氫為氧化劑,若100L“酸溶”所得溶液中Fe 2+含量為1.2molL1,則需投入的氧化劑過氧化氫的質量為_____________。
(4)氧化時,除可外加氧化劑外,也可采用惰性電極電解的方法,此時陰極的電極反應式為____,電解總反應的離子方程式是 ___。
(5)將得到的FeCl3溶液在HCl氣氛中_________、過濾、洗滌、干燥得FeCl36H2O晶體。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)鉛蓄電池(原電池)工作時,總反應為Pb +PbO2+2H2SO4→2PbSO4 +2H2O 由此可以判斷:
A.原電池的電極材料:①正極為____,②負極為___。
B.工作后,蓄電池里電解質溶液的pH___(填“變大”“變小”或“不變”),理由是____。
(2)如圖所示,水槽中試管內有一枚鐵釘,放置數天觀察:

a.若試管內液面上升,則原溶液是___性,發生_____腐蝕,電極反應,正極為_____。
b.若試管內液面下降,則原溶液呈____性,發生____腐蝕,電極反應:負極為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在t℃時,稀硫酸和鹽酸混合液中,c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,向20mL該混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的量如圖所示,當加入60mL Ba(OH)2溶液時,C點溶液的pH=6(體積變化忽略不計),試計算:
(1)t℃時,Kw=___,最初混合酸中c(SO42-)=___,c(Cl-)=____。
(2)A點pH=_____。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T K時,向2.0L恒容密閉容器中充入0.10molCOCl2,發生反應 ![]() ,經過一段時間后反應達到平衡。反應過程中測得的部分數據見下表,下列說法正確的是
,經過一段時間后反應達到平衡。反應過程中測得的部分數據見下表,下列說法正確的是
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
A. 反應在前2s的平均速率![]() mol·L-1·s-1
mol·L-1·s-1
B. 保持其他條件不變,升高溫度,若新平衡時c(C12)=0.038mol·L-1,則反應的△H<0
C. 平衡后向上述容器中再充入0.10molCOCl2,平衡正向移動,COCl2的轉化率增大
D. T K時該反應的化學平衡常數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下如圖,關閉活塞,在左右兩室(體積相同)各充入一定量H2和Cl2,且恰好使兩容器內氣體密度相同,打開活塞,點燃使H2與Cl2充分反應生成氯化氫氣體:H2+Cl2=2HCl,恢復到原溫度后,下列判斷正確的是
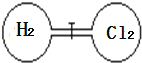
A. 開始時左右兩室分子數相同
B. 最終容器內無H2存在
C. 反應前后H2室壓強相同
D. 最終容器內密度與原來相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素R、X、Y、Z的原子序數依次增大,由這些元素組成的物質之間的轉化關系如圖所示,其中c、d為單質,a、b、g為二元化合物。b是10電子分子,g是18電子分子。下列說法正確的是

A. 同溫同濃度的e和f溶液,后者pH較大
B. 含X、R、Z三種元素的化合物只有一種
C. 0.1mol的d與足量的e溶液反應轉移電子數約為 1.204×1023
D. e和f含化學鍵類型相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Mn2O3是一種重要的工業原料,在電磁和有機合成等領域應用廣泛。某學習小組在實驗室用CH4還原MnO2制備Mn2O3,并測定產品純度。請回答下列問題:
Ⅰ.制備(實驗裝置如圖所示)

已知:Al4C3+12H2O==4Al(OH)3+3CH4↑。
(1)儀器a的名稱為______________________
(2)用稀醋酸代替水的優點有________________________________________
(3)連接好實驗裝置,檢驗裝置的氣密性并加入相應試劑。向燒瓶中滴加稀醋酸之后,在點燃酒精燈之前應進行的操作是__________________________________
(4)儀器b中同時生成兩種能參與大氣循環的物質,該反應的化學方程式為______________
(5)指出上述實驗裝置有一處明顯的缺陷____________________________
Ⅱ.測定產品中Mn2O3的純度(只考慮產品中混有少量未參與反應的MnO2)
ⅰ.實驗結束后,取儀器b中所得固體7.19g,加入足量硫酸酸化的KI溶液,使固體中錳元素全部轉化為Mn2+;
ⅱ.將所得溶液稀釋至500mL;
ⅲ.取25.00mL稀釋后的溶液,滴加幾滴淀粉溶液,用0.200molL-1的Na2S2O3標準溶液滴定,達到滴定終點時,消耗25.00mLNa2S2O3標準溶液。(已知:I2+2 Na2S2O3==Na2S4O6+2NaI)
(1)步驟ⅰ中發生反應的離子方程式為________________________________________
(2)滴定終點的標志是__________________________________________________
(3)所取固體中Mn2O3的質量分數為___________________(計算結果精確到0.1%)
(4)下列操作使測定結果偏高的是______________
A.滴定前平視,滴定終點俯視讀數
B.盛放Na2S2O3標準溶液的滴定管未用標準液潤洗
C.硫酸酸化的KI溶液在空氣中靜置時間過長
D.滴定前正常,滴定后滴定管尖嘴內有氣泡
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com