
| A | 單質在自然界中硬度最大 |
| B | 原子中s能級與p能級電子數相等且有單電子 |
| C | C在B的下一周期,C的電離能數據(kJ•mol-1)為:I1=738I2=1451I3=7732I4=10540 |
| D | 單質密度小,較好的延展性,廣泛用于食品包裝,D的氧化物是兩性氧化物 |
| E | 單質是一種常見金屬,與B元素能形成黑色和磚紅色兩種氧化物 |
分析 A、B、C、D、E是元素周期表中前四周期常見元素,原子序數依次增大,A單質在自然界中硬度最大,則A為碳元素;
B原子中s能級與p能級電子數相等且有單電子,則B的核外電子排布為1s22s22p4,故B為N元素;
由C原子的第一至第四電離能數據可知,第三電離能劇增,故C表現+2價,處于ⅡA族,且在B的下一周期,故C為Mg元素;
D單質密度小,較好的延展性,廣泛用于食品包裝,D的氧化物是兩性氧化物,則D為Al元素;
E單質是一種常見金屬,與O元素能形成黑色和磚紅色兩種氧化物,則E為Cu元素,據此解答.
解答 解:A、B、C、D、E是元素周期表中前四周期常見元素,原子序數依次增大,A單質在自然界中硬度最大,則A為碳元素;
B原子中s能級與p能級電子數相等且有單電子,則B的核外電子排布為1s22s22p4,故B為N元素;
由C原子的第一至第四電離能數據可知,第三電離能劇增,故C表現+2價,處于ⅡA族,且在B的下一周期,故C為Mg元素;
D單質密度小,較好的延展性,廣泛用于食品包裝,D的氧化物是兩性氧化物,則D為Al元素;
E單質是一種常見金屬,與O元素能形成黑色和磚紅色兩種氧化物,則E為Cu元素,
(1)常溫下,某氣態單質甲分子與CO分子核外電子數相等,則甲為N2,分子中形成N≡N,一個氮氣分子中包含2個π鍵;
故答案為:2;
(2)氮的氫化物,中心原子的雜化類型是sp3,分子的空間構型 V形,氨分子間存在氫鍵,其熔沸點比與它同主族的下一周期元素的氫化物的熔沸點高,故答案為:sp3;V形;水分子間存在氫鍵;
(3)鋁元素原子核外有13個電子,所以有13種運動狀態不同的電子,鋁與氫氧化鈉反應生成偏鋁酸鈉和氫氣,該原電池的負極是鋁發生氧化反應,生成偏鋁酸根離子,其電極反應式為:Al-3e-+4OH-=AlO2-+2H2O,故答案為:13;Al-3e-+4OH-=AlO2-+2H2O;
(4)Cu是29號元素基態原子的價電子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1,銅是面心立方最密堆積,故答案為:1s22s22p63s23p63d104s1或[Ar]3d104s1;面心立方最密堆積.
點評 本題考查結構性質位置關系應用、核外電子排布規律、原電池、氫鍵等,難度中等,書寫原電池負極電極反應,綜合性強.


 浙大優學小學年級銜接捷徑浙江大學出版社系列答案
浙大優學小學年級銜接捷徑浙江大學出版社系列答案科目:高中化學 來源: 題型:實驗題
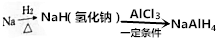 四氫鋁鈉(NaAlH4)在化工生產中有著重要應用.其簡易合成工藝流程如圖所示.
四氫鋁鈉(NaAlH4)在化工生產中有著重要應用.其簡易合成工藝流程如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向品紅溶液中滴加亞硫酸 | |
| B. | KMnO4溶液滴定NaHSO3溶液,溶液由無色變為淺紅色30s不褪色,即為滴定終點 | |
| C. | 久置氯水變成無色 | |
| D. | 向苯酚溶液中滴加FeCl3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(N2)正=v(NH3)逆 | |
| B. | 單位時間內3 mol H-H發生斷鍵反應,同時2 mol N-H發生也斷鍵反應 | |
| C. | n(N2):n(H2):n(NH3)=1:3:2 | |
| D. | 反應混合物各組分的物質的量濃度不再改變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液質量減輕 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+與Fe2+的物質的量比為1:1 | |
| D. | 1 mol Fe可還原2 mol Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;1mol O22+中含有的π鍵數目為2NA.
;1mol O22+中含有的π鍵數目為2NA.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原電池是將電能轉化為化學能的裝置 | |
| B. | 原電池中發生氧化反應的是負極 | |
| C. | 電解池是將化學能轉化為電能的裝置 | |
| D. | 電解池中發生氧化反應的是陰極 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 此烴名稱為4-甲基-1-戊炔.
此烴名稱為4-甲基-1-戊炔. 的烴可命名為1-甲基-3-乙基苯.
的烴可命名為1-甲基-3-乙基苯. 的烴可命名為:2,4-二甲基-3-乙基戊烷.
的烴可命名為:2,4-二甲基-3-乙基戊烷. 的鍵線式:
的鍵線式: .
. 的鍵線式:
的鍵線式: .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com