
【題目】深井巖鹽的主要配料為:精制鹽、碘酸鉀(KIO3)、亞鐵氰化鉀[K4Fe(CN)6·3H2O]。其中亞鐵氰化鉀的無水鹽在高溫下會發生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C。請回答下列問題:
2(CN)2↑+12KCN+N2↑+Fe3C+C。請回答下列問題:
(1)①基態Fe原子價電子排布圖(軌道表示式)為_________________________
②C、N和O三種元素的第一電離能的大小順序為_____________,原因是__________。
③IO3-的中心原子的雜化方式為______。一種與CN-互為等電子體的分子的電子式為_______。
④1molFe(CN)63中含有σ鍵的數目為____mol。
(2)配合物Fe(CO)x的中心原子價電子數與配體提供電子數之和為18,則x=___。Fe(CO)x常溫下呈液態,熔點為-20.5℃,沸點為103℃,易溶于非極性溶劑,據此可判斷Fe(CO)x晶體屬于__________(填晶體類型)。
(3)如圖是從鐵氧體離子晶體Fe3O4中取出的能體現其晶體結構的一個立方體,該立方體中三價鐵離子處于氧離子圍成的________(填空間結構)空隙。
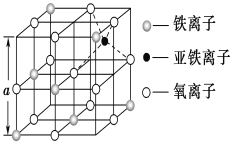
(4)Fe能形成多種氧化物,其中FeO晶胞結構為NaCl型。晶體中實際上存在空位、錯位、雜質原子等缺陷,晶體缺陷對晶體的性質會產生重大影響。由于晶體缺陷,在晶體中Fe和O的個數比發生了變化,變為FexO(x<1),若測得某FexO晶體密度為5.71gcm﹣3,晶胞邊長為4.28×10﹣10 m,則FexO中x=____。(用代數式表示,不要求算出具體結果)。
【答案】![]() N>O>C 同一周期中,第一電離能呈增大趨勢,但N處于VA族,其最外層p能級處于半充滿狀態,第一電離能反常 sp3
N>O>C 同一周期中,第一電離能呈增大趨勢,但N處于VA族,其最外層p能級處于半充滿狀態,第一電離能反常 sp3 ![]() 、
、![]() 12 5 分子晶體 正八面體
12 5 分子晶體 正八面體 ![]()
【解析】
根據核外電子排布規律書寫價電子的軌道排布式;根據第一電離能的概念及全滿、半滿結構分析比較第一電離能的大小;根據價層電子對數判斷中心原子的軌道雜化方式,根據等電子體概念判斷等電子體;根據化學鍵的類型計算微粒中σ鍵的數目;根據晶胞的結構分析微粒間構成的空間構型,通過密度和體積進行相關計算;根據物質的物理性質分析判斷晶體類型。
(1)①鐵為26號元素,基態Fe原子核外電子排布式為[Ar]3d64s2,根據泡利不相容原理及洪特規則分析知價電子軌道表示式為:![]() ,故答案為:
,故答案為:![]() ;
;
②同一周期中,第一電離能呈增大趨勢,但N處于VA族,其最外層p能級處于半充滿狀態,第一電離能反常,更穩定些,所以第一電離能更大些,故答案為:N>O>C;同一周期中,第一電離能呈增大趨勢,但N處于VA族,其最外層p能級處于半充滿狀態,第一電離能反常;
③IO3-價層電子對數=![]() (O原子按不提供電子算),則根據價層電子對互斥理論分析,其中心原子的雜化方式為sp3;等電子體是原子總數相等,價電子總數相等的微粒,故與CN-互為等電子體的分子是CO或N2,它們的電子式為
(O原子按不提供電子算),則根據價層電子對互斥理論分析,其中心原子的雜化方式為sp3;等電子體是原子總數相等,價電子總數相等的微粒,故與CN-互為等電子體的分子是CO或N2,它們的電子式為![]() 、
、![]() ;故答案為:sp3;
;故答案為:sp3;![]() 、
、![]() ;
;
④C原子與N形成叁鍵,其中1個是σ鍵,2個是π鍵,CN-與鐵離子之間有6個配位鍵,所以1molFe(CN)63中含有σ鍵的數目為12mol,故答案為:12;
(2)Fe原子價電子數為8,CO提供一對孤對電子,與Fe原子形成配位鍵,則8+2x=18,則x=5;配合物Fe(CO)x的熔沸點比較低,易溶于非極性溶劑,應屬于分子晶體,故答案為:5;分子晶體;
(3)如圖所示,氧離子處于三價鐵離子的前后左右和上下,則構成的空間結構為正八面體,故答案為:正八面體;
(4)FexO晶胞結構為NaCl型,所以每個晶胞中含有4個O原子,有4個“FexO”,再根據m=ρV可知:![]() ,則x=
,則x=![]() ,故答案為:
,故答案為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】配制一定物質的量濃度的溶液,下列說法正確的是
A.容量瓶未干燥即用來配置溶液導致配置溶液濃度偏低
B.把4.0gCuSO4溶于250mL蒸餾水中配置250mL0.1mol/LCuSO4溶液
C.轉移溶液沒有用蒸餾水洗滌燒杯,直接用蒸餾水定容,導致配制溶液濃度偏低
D.稱取硫酸銅晶體45g,配置90mL 2mol/L的硫酸銅溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有a、b、c、d四個金屬電極,有關的反應裝置及部分反應現象如下,由此可判斷這四種金屬的活動性順序是( )
實驗裝置 |
|
|
|
|
部分實驗現象 | a極質量減小,b極質量增加 | b極有氣體產生,c極無變化 | d極溶解,c極有氣體產生 | 電流計指示,導線中電流從a極流向d極 |
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海波![]() 是無色透明的晶體,易溶于水,遇酸立即分
是無色透明的晶體,易溶于水,遇酸立即分![]() ,硫化堿法是工業上制備海波的方法之一,反應原理為:
,硫化堿法是工業上制備海波的方法之一,反應原理為:![]() 某研究小組在實驗室用硫化堿法制備
某研究小組在實驗室用硫化堿法制備![]() ,實驗裝置如圖所示:
,實驗裝置如圖所示:

![]() 裝置A中滴加濃硫酸的儀器名稱是 ______ ,實驗室還可以用A裝置制取的氣體單質的離子方程式是 ______ .
裝置A中滴加濃硫酸的儀器名稱是 ______ ,實驗室還可以用A裝置制取的氣體單質的離子方程式是 ______ .
![]() 裝置D的作用是檢驗裝置C中
裝置D的作用是檢驗裝置C中![]() 的吸收效率,D中的試劑可以是 ______
的吸收效率,D中的試劑可以是 ______ ![]() 表明
表明![]() 吸收效率低的實驗現象是 ______ .
吸收效率低的實驗現象是 ______ .
![]() 實驗制得的
實驗制得的![]() 產品中可能含有
產品中可能含有![]() 、
、![]() 等雜質.請設計實驗,檢測
等雜質.請設計實驗,檢測![]() 產品中是否存在
產品中是否存在![]() 雜質,簡要說明實驗操作、現象和結論: ______ .
雜質,簡要說明實驗操作、現象和結論: ______ .
![]() 溶液是定量實驗中的常用試劑,為了測定某
溶液是定量實驗中的常用試劑,為了測定某![]() 溶液的濃度,研究小組的同學準確量取
溶液的濃度,研究小組的同學準確量取![]() 溶液于錐形瓶中,加入過量KI固體和適量的稀
溶液于錐形瓶中,加入過量KI固體和適量的稀![]() ,滴加指示劑,用
,滴加指示劑,用![]() 標準溶液滴定至終點,3次平行實驗測得平均消耗
標準溶液滴定至終點,3次平行實驗測得平均消耗![]() 溶液的體積為
溶液的體積為![]() ,則
,則![]() ______
______ ![]() 已知:
已知:![]() ,
,![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在室溫下,下列說法正確的是![]()
![]()
A.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好無色,則此時溶液的
至溶液恰好無色,則此時溶液的![]()
B.同![]() 的溶液:
的溶液:![]() 溶液,物質的量濃度最大的是
溶液,物質的量濃度最大的是![]()
C.有兩種酸HA和HB,已知HA的酸性比HB弱,在物質的量濃度均為![]() 的NaA和NaB混合溶液中,有
的NaA和NaB混合溶液中,有![]()
D.pH相同的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、NaOH溶液,其濃度大小關系為:
溶液、NaOH溶液,其濃度大小關系為:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關系圖中,A 是一種正鹽,B 是氣態氫化物,C 是單質,F 是強酸。當 X 無論是強酸還是強堿時都有如下轉化關系(其他反應產物及反應所需條件均已略去),當 X 是強堿時,過量的 B 跟 Cl2 反應除生成 C 外,另一產物是鹽酸鹽。
下列說法中不正確的是( )
![]()
A.當 X 是強酸時,A、B、C、D、E、F中均含同一種元素,F 可能是 H2SO4
B.當 X 是強堿時,A、B、C、D、E、F中均含同一種元素,F 是 HNO3
C.用 O2 代替 Cl2, 也能與 B 反應生成 C 物質
D.當 X 是強酸時,C 在常溫下是一種易溶于酒精的固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向濃度相等、體積均為100 mL的A、B兩份NaOH溶液中,分別通入一定量的CO2后,逐滴加入0.1 mol/L的鹽酸,產生CO2的體積(標準狀況)與所加鹽酸的體積關系如圖所示。

(1)A曲線表明,原溶液通入CO2 ________mL(標準狀況)。
(2)B曲線表明,原溶液通入CO2后,所得溶液中溶質的物質的量之比為__________。
(3)原NaOH溶液的物質的量濃度為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質一定屬于同系物的( )
①![]() ②
②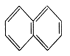 ③
③![]() ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦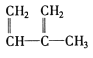 ⑧
⑧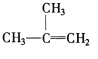
A.④和⑥B.①、②和③C.⑤和⑦D.④⑥和⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國制堿工業的先驅——侯德榜先生發明了著名的侯氏制堿法,其核心反應原理可用如下化學方程式表示:NH3+CO2+NaCl+H2O→NH4Cl+NaHCO3(晶體)。依據此原理,欲制得碳酸氫鈉晶體,某校學生設計了如下實驗裝置,其中B裝置中的試管內是溶有氨和氯化鈉的溶液,且二者均已達到飽和。

(1)A裝置中所發生反應的離子方程式為___。C裝置中稀硫酸的作用為___。
(2)下表中所列出的是相關物質在不同溫度下的溶解度數據(g/100g水)
溫度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
參照表中數據,請分析B裝置中使用冰水的目的是___。
(3)該校學生在檢查完此套裝置氣密性后進行實驗,結果沒有得到碳酸氫鈉晶體,指導教師指出應在___裝置與___裝置之間(填寫字母)連接一個盛有___的洗氣裝置,其作用是___。
(4)若該校學生進行實驗時,所用飽和食鹽水中含NaCl的質量為5.85g,實驗后得到干燥的NaHCO3晶體的質量為5.04g,則NaHCO3的產率為___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com