
【題目】鉻是一種銀白色的金屬,常用于金屬加工、電鍍等。工業以鉻鐵礦[主要成分是Fe(CrO2)2]為原料冶煉鉻及獲得強氧化劑Na2Cr2O7。其工藝流程如圖所示:
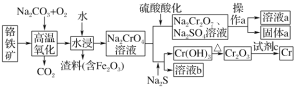
已知:高溫氧化時發生反應Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2(未配平)
回答下列問題:
(1)將鉻鐵礦的主要成分Fe(CrO2)2寫成氧化物的形式:__,高溫氧化時可以提高反應速率的方法為___(寫出一條即可)。
(2)Na2CrO4加入硫酸酸化的離子方程式為__;在實驗室中,操作a所用到的玻璃儀器有__。
(3)Na2CrO4中鉻元素化合價為__;生成1molNa2CrO4時共轉移電子的物質的量為__mol。
(4)根據有關國家標準,含CrO42-的廢水要經化學處理,使其濃度降至5.0×10-7mol·L-1以下才能排放,可采用加入可溶性鋇鹽生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸處理多余的Ba2+的方法處理廢水,加入可溶性鋇鹽后,廢水中Ba2+的濃度應大于__mol·L-1,廢水處理后達到國家標準才能排放。
【答案】FeO·Cr2O3 將固體磨碎或不斷攪拌 2CrO42-+2H+=Cr2O72-+H2O 燒杯、漏斗、玻璃棒 +6 3.5 2.4×10-4
【解析】
鉻鐵礦[主要成分是Fe(CrO2)2]中加入碳酸鈉并通入氧氣,高溫下將Fe(CrO2)2氧化得到Fe2O3、Na2CrO4,同時生成CO2,將得到的固體溶于水得到Na2CrO4溶液。向一份Na2CrO4溶液中加入硫酸酸化,硫酸和Na2CrO4反應生成Na2Cr2O7和硫酸鈉,通過蒸發濃縮、冷卻結晶,過濾得到固體a和溶液a;另一份Na2CrO4溶液中加入Na2S發生氧化還原反應,鉻元素轉化為Cr(OH)3沉淀,過濾后灼燒Cr(OH)3得到Cr2O3,可以利用熱還原法制備金屬鉻;據此分析解答。
(1)Fe(CrO2)2 中鐵元素化合價是+2價,氧化物為FeO,鉻元素化合價+3價,氧化物為Cr2O3,所以Fe(CrO2)2寫成氧化物形式為FeOCr2O3;增大反應物的接觸面積可以加快反應速率,升高溫度可以加快反應速率,不斷攪拌,使固體混合物充分混合也可以加快反應速率,故答案為:FeOCr2O3 ;將固體磨碎或不斷攪拌等;
(2)Na2CrO4加入硫酸酸化反應生成重鉻酸鈉,反應的離子方程式為2CrO42-+2H+=Cr2O72-+H2O;操作a為過濾,所用到的玻璃儀器有燒杯、漏斗、玻璃棒,故答案為:2CrO42-+2H+=Cr2O72-+H2O;燒杯、漏斗、玻璃棒;
(3)Na2CrO4中Na元素為+1價,O為-2價,則鉻元素化合價為+6價;根據Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2,反應中鉻元素由+3價升高為+6價,鐵元素由+2價升高為+3價,1mol Fe(CrO2)2被氧化轉移7mol電子,因此生成1molNa2CrO4時轉移3.5mol電子,故答案為:+6;3.5;
(4)CrO42-+Ba2+BaCrO4,根據題意CrO42-的濃度降至5.0×10-7mol·L-1以下才能排放,則Ksp(BaCrO4)=c(CrO42-)×c(Ba2+)=5.0×10-7×c(Ba2+)=1.2×10-10,解得:c(Ba2+)=2.4×10-4mol/L,即Ba2+的濃度應大于2.4×10-4mol/L,故答案為:2.4×10-4。


科目:高中化學 來源: 題型:
【題目】“飄塵”是物質燃燒時產生的粒子漂浮物,顆粒很小(直徑小于10-7m),不易沉降(可漂浮數小時甚至數年),它與空氣中SO2、O2接觸時,SO2部分轉化為SO3,使空氣中酸度增加形成酸雨。
(1)下列關于SO2的敘述中,正確的是_____;
A.SO2既可以做氧化劑,也可以做還原劑 B.SO2不是大汽污染物 C.大氣中SO2的主要來源是汽車排出的尾氣 D.SO2具有漂白性,因而可以使石蕊溶液褪色
(2)下列反應中,SO2表現了還原性的是_______;
A.SO2+H2OH2SO3 B.SO2+2NaOH=Na2CO3+H2O C.2SO2+O2![]() 2SO3 D.SO2+CaO=CaSO3
2SO3 D.SO2+CaO=CaSO3
(3)不能鑒別二氧化碳和二氧化硫的試劑是________;
A.品紅溶液 B.澄清石灰水 C.溴水 D.酸性高錳酸鉀溶液
(4)下列哪種危害不是酸雨導致的_______;
A.造成洪澇災害 B.腐蝕建筑物 C.惡化人類環境 D.導致樹木枯萎
(5)根據SO2通入不同溶液中實驗現象,所得結論不正確的是_______;
溶液 | 現象 | 結論 | |
A | 含HCl、BaCl2的FeCl3溶液 | 產生白色沉淀 | SO2有還原性 |
B | H2S溶液 | 產生黃色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 |
D | Na2SiO3溶液 | 產生膠狀沉淀 | 酸性:H2SO3>H2SiO3 |
(6)減少酸雨產生的途徑可采取下列的哪些措施___________。
①少用煤做燃料 ②把工廠煙囪造高 ③燃料脫硫 ④飛機、汽車等交通工具采用清潔燃料,如天然氣等 ⑤開發新能源
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由W、X、Y、Z四種金屬按下列裝置進行實驗。下列說法不正確的是( )
裝置 |
|
|
|
現象 | 金屬W不斷溶解 | Y的質量增加 | W上有氣體產生 |
A.裝置甲中X作原電池正極
B.裝置乙中Y電極上的反應式為Cu2++2e=Cu
C.裝置丙中溶液的c(H+)不變
D.四種金屬的活動性強弱順序為Z>W>X>Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯與液溴制取溴苯:

(1)裝置A的名稱是_______________。
(2)制取溴苯的化學反應方程式_____________。
(3)反應時,裝置B中出現的現象有___________。
(4)冷凝水順序_______(A.上進下出;B.下進上出),長導管的作用____________,請解釋裝置C中導管位置為什么不能伸入液面以下____________。
(5)裝置D的作用是__________。
(6)反應結束后,將滴液漏斗中的溶液E加入到燒瓶B中,充分振蕩后可除去溴苯中的溴,溶液E是_______________;液體經過分液,所得的溴苯中還含有少量苯,如何進行分離________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,三硫代碳酸鈉(Na2CS3)是玫瑰紅色針狀固體,與碳酸鈉性質相近。在工農業生產中有廣泛的用途。某小組設計實驗探究三硫代碳酸鈉的性質并測定其溶液的濃度。
實驗一:探究Na2CS3的性質
(1)向Na2CS3溶液中滴入酚酞試液,溶液變紅色。用離子方程式說明溶液呈堿性的原因__。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。該反應中被氧化的元素是__。
實驗二:測定Na2CS3溶液的濃度
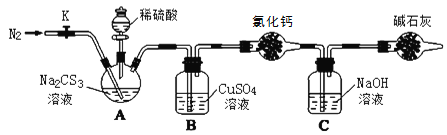
按如圖所示連接好裝置,取50.0mLNa2CS3溶液置于三頸瓶中,打開分液漏斗的活塞,滴入足量2.0mol·L-1稀H2SO4,關閉活塞。
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸點46℃,密度1.26g·mL-1,與CO2某些性質相似,與NaOH作用生成Na2COS2和H2O。
(3)盛放堿石灰的儀器的名稱是__,堿石灰的主要成分是__(填化學式)。
(4)反應結束后打開活塞K,再緩慢通入熱N2一段時間,其目的是_。
(5)C中發生反應的離子方程式是__。
(6)為了計算Na2CS3溶液的濃度,對充分反應后B中混合物進行過濾、洗滌、干燥、稱重,得8.4g固體,則三頸瓶中Na2CS3的物質的量濃度為__。
(7)分析上述實驗方案,還可以通過測定C中溶液質量的增加值來計算Na2CS3溶液的濃度,若反應結束后將通熱N2改為通熱空氣,計算值__(填“偏高”、“偏低”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水電池常用在海上浮標等助航設備中,其示意圖如圖所示。電池反應為2Li+2H2O=2LiOH+H2↑。電池工作時,下列說法錯誤的是( )

A.金屬鋰作負極
B.電子從鋰電極經導線流向鎳電極
C.海水作為電解質溶液
D.可將電能轉化為化學能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以淀粉為主要原料合成一種具有果香味的物質C和化合物D的合成路線如下圖所示。
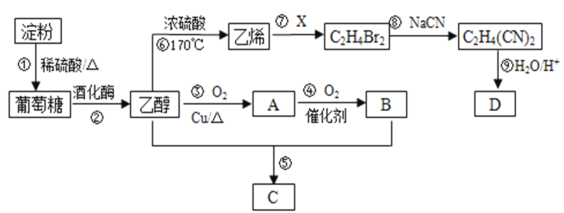
請回答下列問題:
(1)A的結構簡式為________,B分子中的官能團名稱為________。
(2)反應③的化學方程式為_______。
(3)反應⑤的化學方程式為_________。
(4)已知D的相對分子量為118,有酸性且只含有一種官能團,其中碳、氫兩元素的質量分數分別為40.68%、5.08%,其余為氧元素,則D的化學式為______,其結構簡式為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為原電池裝置示意圖:
(1)將鋁片和銅片用導線相連,一組插入濃硝酸中,一組插入燒堿溶液中,分別形成了原電池,在這兩個原電池中,負極分別為______。
A.鋁片、銅片 B.銅片、鋁片 C.鋁片、鋁片 D.銅片、銅片
寫出插入燒堿溶液中形成原電池的負極反應式_________。
(2)若A為Pb,B為PbO2,電解質為硫酸溶液,寫出B電極反應式:_________;該電池在工作時,A電極的質量將______(填“增重”或“減輕”或“不變”)。若消耗0.1moLH2SO4時,則轉移電子數目為______。
(3)若A、B均為鉑片,電解質為KOH溶液,分別從A、B兩極通入H2和O2,該電池即為氫氧燃燒電池,寫出A電極反應式:_________;該電池在工作一段時間后,溶液的堿性將______(填“增強”或“減弱”或“不變”)。
(4)若A、B均為鉑片,電解質為硫酸溶液,分別從A、B兩極通入CH4和O2,該電池即為甲烷燃燒電池,寫出A電極反應式:_________;電池工作時陰離子定向移動到______極(填“正”或“負”)。
(5)鐵、銅、鋁是生活中使用廣泛的金屬,FeCl3溶液常用于腐蝕印刷電路銅板,其反應過程的離子方程式為_________,若將此反應設計成原電池,則負極所用電極材料為______,正極反應式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D四種短周期元素,它們的原子序數由A到D依次增大,已知A和B原子有相同的電子層數,且A的L層電子數是K層電子數的兩倍,C燃燒時呈現黃色火焰,C的單質在點燃條件下與B的單質充分反應,可以得到淡黃色固態化合物,D的M層電子數為K層電子數的3倍.試根據以上敘述回答:
(1)寫出元素名稱:A D ;
(2)畫出D的原子結構示意圖 ;
(3)用電子式表示化合物C2D的形成過程 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com