
【題目】某校學生為探究苯與溴發生反應的原理,用如圖裝置進行實驗.
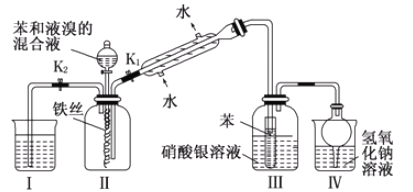
根據相關知識回答下列問題:
(1)實驗開始時,關閉K1,開啟K2和分液漏斗活塞,滴加苯和液溴的混合液,反應開始,反應的化學方程式_____。過一會兒,在(Ⅱ)中瓶底觀察到_____(Ⅲ)中可能觀察到的現象是____
(2)整套實驗裝置中能防止倒吸的裝置有_____(填裝置序號)。
(3)反應結束后要使裝置(I)中的水倒吸入裝置(Ⅱ)中,這樣操作的目的是______
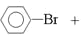
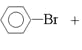
【答案】![]() +Br2
+Br2![]()
 HBr 褐色油狀液體(溴苯) 有白霧出現,廣口瓶內溶液中有淺黃色溴化銀沉淀生成 III和IV 除去溴化氫氣體,以免逸出污染空氣
HBr 褐色油狀液體(溴苯) 有白霧出現,廣口瓶內溶液中有淺黃色溴化銀沉淀生成 III和IV 除去溴化氫氣體,以免逸出污染空氣
【解析】
(1)苯與液溴在鐵做催化劑的條件下發生取代反應生成溴苯和溴化氫;在(Ⅱ)中生成溴苯,(Ⅲ)中溴化氫與硝酸銀溶液反應生成溴化銀;
(2)Ⅲ中導管口在苯的液面以上;干燥管可防倒吸;
(3)根據溴化氫易溶于水分析。
(1)苯與液溴在鐵做催化劑的條件下發生取代反應生成溴苯和溴化氫,反應方程式是![]() +Br2
+Br2![]()
 HBr;在(Ⅱ)中生成溴苯,現象是有褐色油狀液體;(Ⅲ)中溴化氫與硝酸銀溶液反應生成溴化銀,現象是有白霧出現,廣口瓶內溶液中有淺黃色溴化銀沉淀生成;
HBr;在(Ⅱ)中生成溴苯,現象是有褐色油狀液體;(Ⅲ)中溴化氫與硝酸銀溶液反應生成溴化銀,現象是有白霧出現,廣口瓶內溶液中有淺黃色溴化銀沉淀生成;
(2)Ⅲ中導管口在苯的液面以上可防倒吸;干燥管體積較大可防倒吸,整套實驗裝置中能防止倒吸的裝置有Ⅲ和IV;
(3)溴化氫易溶于水,反應結束后要使裝置(I)中的水倒吸入裝置(Ⅱ)中,可以除去溴化氫氣體,以免逸出污染空氣。


科目:高中化學 來源: 題型:
【題目】可逆反應 A(g) + 2B(g) ![]() 2C(g) ΔH<0,在一定條件下達到平衡,若改變條件,將變化結果(“增大”、“減小”或“不變”)填入空格。
2C(g) ΔH<0,在一定條件下達到平衡,若改變條件,將變化結果(“增大”、“減小”或“不變”)填入空格。
(1)升高溫度,B的轉化率_____________,v(正)____________,v(逆)____________。
(2)保持溫度和壓強不變,加入惰性氣體,則C的物質的量_____________,A的轉化率_____________。
(3) 保持溫度和體積不變,加入惰性氣體,A的轉化率_____________。
(4)若溫度和體積不變,反應從開始到平衡,容器內氣體的密度_____________,壓強____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、W為五種短周期元素,X、Y、Z是原子序數依次增大的同周期元素,且最外層電子數之和為15,X與Z可形成XZ2分子;Y與M形成的氣態化合物在標準狀況下的密度為0.76 g·L-1;W的質子數是X、Y、Z、M四種元素質子數之和的1/2。下列說法正確的是
A. 原子半徑:W>Z>Y>X>M
B. 常見氣態氫化物的穩定性:X<Y<Z
C. 1 mol WM溶于足量水中完全反應,共轉移2 mol電子
D. 由X、Y、Z、M四種元素形成的化合物一定既有離子鍵,又有共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】美宇航局(NASA)提醒人類:環保、素食、節能將有效抑制溫室效應;否則兩極冰山融化,將引發一系列災難。美國宇航局(NASA)科研人員發現了一種比二氧化碳高104倍的“超級溫室氣體”全氟丙烷(C3F8),提醒人們慎用含氟物。有關全氟丙烷的說法正確的是
A. 分子中的三個碳原子可能處于同一直線上
B. 全氟丙烷的電子式為: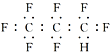
C. 由丙烷轉化為全氟丙烷的反應為取代反應
D. 全氟丙烷可由全氟丙烯(CF2=CFCF3)與H2加成得到
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。微粒物質的量的變化如圖所示。下列說法正確的是
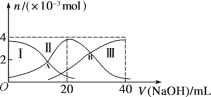
A. 當V(NaOH)=20 mL時,溶液中離子濃度關系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B. 當V(NaOH)=30 mL時,則有:2c(H+) + c(HA-) +2c(H2A) =c(A2-) +2c(OH-)
C. 向上述加入20 mL NaOH溶液后所得溶液中再加入水的過程中,pH減小
D. 若A、B兩點對應的溶液pH值分別為a、b,則H2A![]() 2H++A2-的K=10-a-b
2H++A2-的K=10-a-b
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫條件下,欲使CH3COONa溶液中c(CH3COO-)/c(Na+)的比值增大,可在溶液中加入下列物質中正確的是①固體NaOH ②固體KOH ③固體NaHS ④固體CH3COONa ⑤冰醋酸 ⑥加水
A. ②③④⑤ B. ②④⑤ C. ②⑤⑥ D. ①⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A部分:由鋯英砂(ZrO2·SiO2,還含少量Fe2O3、Al2O3、SiO2等雜質)制備ZrO2的流程如下:

已知:①ZrO2在強堿性溶液中以ZrO32-形式存在,在強酸性溶液中以ZrO2+形式存在。
②部分金屬離子在實驗條件下開始沉淀和完全沉淀的pH如下表。
Mn+ | Fe3+ | Al3+ | ZrO2+ |
開始沉淀時pH | 1.9 | 3.3 | 6.2 |
沉淀完全時pH | 3.8 | 5.6 | 8.0 |
(1)操作I所需要的玻璃儀器為___________,操作I除了得到溶液a還可得到_________。
(2)加氨水至溶液a中調節pH的的范圍是________________。
(3)操作II會得到濾液b和濾渣II,濾渣II分離過程如下:
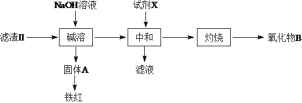
氧化物B的化學式為__________。若試劑X為鹽酸,缺點是___________。
(4)操作III除得到Zr(OH)4外還得到某種溶液,向該溶液中加入CaCO3粉末并加熱,得到兩種氣體。該反應的離子方程式為_____________________________。
(5)加入氨水至溶液b發生的離子方程式為__________________________。
(6)為得到純凈的ZrO2,Zr(OH)4需要洗滌,檢驗Zr(OH)4是否洗滌干凈的方法是______________。
B部分:鈦精礦是從鈦鐵礦或鈦磁鐵礦中采選出來,主要成分為FeTiO3,是生產用途非常廣泛的鈦白粉的原料。以鈦精礦石為原料制備金屬鈦的流程如下圖所示(某些過濾過程已忽略)。已知強酸性溶液中,+4價的鈦元素以TiO2+形式存在,金屬鈦不溶于稀非氧化性酸。回答下列問題:

(1)步驟②中加入鐵屑的作用是__________________。
(2)晶體K俗稱綠礬,晶體K的化學式為____________。
(3)試寫出溶液C加熱制備鈦酸沉淀的化學方程式__________________________________。
(4)步驟⑥加入過量的活性炭,則發生的化學方程式為_______________,已知TiO2+2Cl2![]() TiCl4+O2為吸熱反應,且該條件下反應也能夠發生,為何制備TiCl4過程中還要加入活性炭,試解釋原因_________________。
TiCl4+O2為吸熱反應,且該條件下反應也能夠發生,為何制備TiCl4過程中還要加入活性炭,試解釋原因_________________。
(5)氣體F為氬氣,F的作用是_____________________。
(6)溶液H是_________,作用為___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定質量的鎂和鋁的混合物投入100ml鹽酸中,固體全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示.
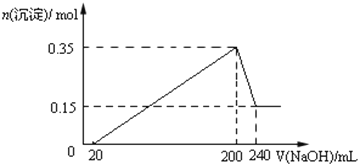
(1)原混合物中鎂和鋁的質量比為_______
(2)NaOH溶液的物質的量濃度為_______ molL﹣1
(3)生成的氣體在標準狀況下的體積為_______ L.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com