
【題目】(1)燃煤發電廠常利用反應2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g);ΔH=-681.8kJ·mol1對煤進行脫硫處理來減少SO2的排放。對于該反應,在T℃時,借助傳感器測得反應在不同時間點上各物質的濃度如下:
時間/min 濃度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min內,平均反應速率v(O2)=___________;②30min后,只改變某一條件,反應重新達到平衡。根據上表中的數據判斷,改變的條件可能是____________(填字母)。
A.加入一定量的粉狀碳酸鈣B.通入一定量的O2
C.適當縮小容器的體積 D.加入合適的催化劑
(2)NOx的排放主要來自于汽車尾氣,有人利用反應C(s)+2NO(g) ![]() N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭對NO進行吸附。已知在密閉容器中加入足量的C和一定量的NO氣體,保持恒壓測得NO的轉化率隨溫度的變化如圖所示:
N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭對NO進行吸附。已知在密閉容器中加入足量的C和一定量的NO氣體,保持恒壓測得NO的轉化率隨溫度的變化如圖所示:
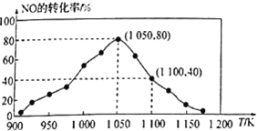
由圖可知,1050K前反應中NO的轉化率隨溫度升髙而增大,其原因為___________,在1050K、1.1×106Pa時,該反應的化學平衡常數Kp=___________(已知:氣體分壓(P分)=氣體總壓(Pa)×體積分數)
(3)為避免汽車尾氣中的有害氣體對大氣的污染,需給汽車安裝尾氣凈化裝置。在凈化裝置中CO和NO發生反應2NO(g)+2CO(g)![]() N2(g)+2CO2
N2(g)+2CO2
①達到平衡后,僅升高溫度,k正增大的倍數____________ (填“>”“<”或“=”)k逆增大的倍數。
②若在1L的密閉容器中充入1mol CO和1mol NO,在一定溫度下達到平衡時,CO的轉化率為40%,則![]() = ____________。
= ____________。
【答案】0.021mol·L-1·min-1 BC 1050K前反應末達到平衡狀態,隨著溫度升高,反應速率加快,NO轉化率增大 4 < ![]()
【解析】
(1)①結合v=△c/△t計算;
②30min后,反應物、生成物濃度均增大;
(2)由圖可知1050K前反應末達到平衡狀態,在1050K、1.1×106Pa時,NO的轉化率為80%,設NO起始量為1mol·L-1,則
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
開始 1 0 0
轉化 0.8 0.4 0.4
平衡 0.2 0.4 0.4
氣體分壓(P分)=氣體總壓(Pa)×體積分數,以此計算Kp;
(3)①焓變為負,為放熱反應,升高溫度平衡逆向移動;
②在1L的密閉容器中充入1mol CO和1mol NO,在一定溫度下達到平衡時,CO的轉化率為40%,則
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
開始 1 1 0 0
轉化 0.4 0.4 0.2 0.4
平衡 0.6 0.6 0.2 0.4
平衡時v正=v逆,即k正/k逆=c(N2)c2(CO2)/c2(NO)c2(CO)。
(1)①0~10min內,平均反應速率v(O2)=(1mol·L-1-0.79mol·L-1)÷10min=0.021mol·L-1·min-1;
②由表中數據可知,30min后,反應物、生成物濃度均增大,則改變條件為通入一定量的O2或適當縮小容器的體積,
故選:BC;
(2)由圖可知,1050K前反應中NO的轉化率隨溫度升髙而增大,其原因為1050K前反應末達到平衡狀態,隨著溫度升高,反應速率加快,NO轉化率增大;
在1050K、1.1×106Pa時,NO的轉化率為80%,設NO起始量為1mol·L-1,則
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
開始 1 0 0
轉化 0.8 0.4 0.4
平衡 0.2 0.4 0.4
Kp=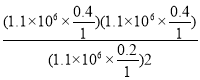 =4
=4
(3)①焓變為負,為放熱反應,升高溫度平衡逆向移動,則僅升高溫度,k正增大的倍數<k逆增大的倍數;
②在1L的密閉容器中充入1mol CO和1mol NO,在一定溫度下達到平衡時,CO的轉化率為40%,則
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
開始 1 1 0 0
轉化 0.4 0.4 0.2 0.4
平衡 0.6 0.6 0.2 0.4
平衡時v正=v逆,即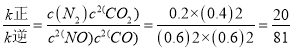 。
。


 新課標階梯閱讀訓練系列答案
新課標階梯閱讀訓練系列答案 口算心算速算應用題系列答案
口算心算速算應用題系列答案科目:高中化學 來源: 題型:
【題目】聚合物F的合成路線圖如下:
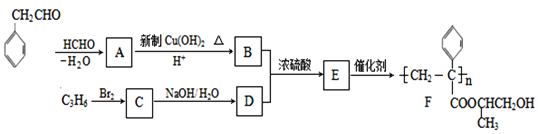
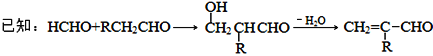
請據此回答:
(1)A中含氧官能團名稱是_______,C的系統命名為_________。
(2)檢驗B中所含官能團所用的試劑有______;E→F的反應類型是___________。
(3)C生成D的反應化學方程式為_____________________________,如果C與NaOH的醇溶液反應,則生成的有機物的結構簡式為________(同一個碳原子上連兩個碳碳雙鍵的除外)。
(4)G物質與![]() 互為同系物,且G物質的相對分子質量比
互為同系物,且G物質的相對分子質量比![]() 大14的,則符合下列條件的G的同分異構體有____種。
大14的,則符合下列條件的G的同分異構體有____種。
① 分子中含有苯環,且苯環上有兩個取代基 ② 遇氯化鐵溶液變紫色
③ 能與溴水發生加成反應
(5) 參照上述合成路線,設計一條由甲醛、乙醛和甲醇為主要原料制備 ![]() 的合成路線__________________。
的合成路線__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組同學欲利用CuO與NH3的反應來研究NH3的某種性質并測定其組成,設計的實驗裝置如圖所示(夾持裝置已省略)。
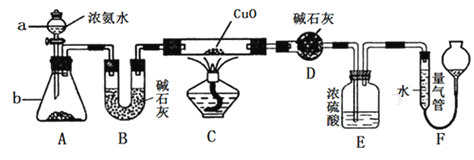
請回答下列問題:
(1)儀器a的名稱為_________;儀器b中盛裝的試劑為_________(填名稱)。
(2)實驗中觀察到裝置C中黑色CuO粉末變為單質銅,且量氣管中有氣體單質產生,上述實驗現象證明NH3具有____________性,寫出相應的化學方程式:_____________。
(3)裝置E中濃硫酸的作用是_________________________________。
(4)實驗結束后,若測得干燥管D增重ag,裝置F中氣體的體積為bL(已折算為標準狀況),則氨分子中氮、氫的原子個數比為___________(用含a、b的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅在自然界中常以多種形態存在,現以孔雀石礦石[成分為Cu2(OH)2CO3、CuFeS2、SiO2、Fe2O3等]為原料生產主產品膽礬和副產品鐵紅的工藝流程如圖:
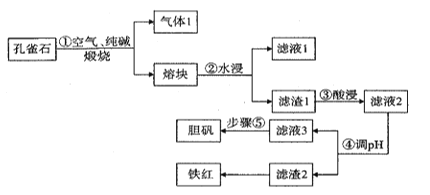
(1)氣體1的成分除H2O(g)外,還有_______________,步驟①中發生氧化還原反應的化學方程式為 ___________________________________________________,濾液1的主要成分的用途之一為________________________________________。
(2)目前工業生產中步驟③酸浸的百分率為70%,為進一步提高酸浸的百分率可采取的措施有__________(答出兩點)。
(3)步驟④調pH所用試劑為_____________ 。
(4)室溫下濾液3的pH=4,Ksp[Fe(OH) 3]=4×10-38,則濾液3中c(Fe3+)=____________。
(5)步驟⑤操作為___________________________________________________________.。
(6)假設使用孔雀石質量為m kg,步驟③酸浸的百分率為70%,經濾渣2所得鐵紅的質量為n kg,則孔雀石礦石中鐵元素的含量為______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,水存在H2O![]() H++OH--Q的平衡,下列敘述一定正確的是
H++OH--Q的平衡,下列敘述一定正確的是
A. 向水中滴入少量稀鹽酸,平衡逆向移動,Kw減小
B. 將水加熱,Kw增大,pH減小
C. 向水中加入少量固體CH3COONa,平衡逆向移動,c(H+)降低
D. 向水中加入少量固體NH4Cl,c(H+)=10-7mol/L,Kw不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中的能量轉化不正確的是( )
選項 | 化學反應 | 能量轉化形式 |
A | CH4+2O2 | 化學能轉化成熱能 |
B | Pb+PbO2+2H2SO4 | 使用時放電,電能轉化成化學能 |
C | mH2O+nCO2 | 光能轉化成化學能 |
D | CaCO3 | 熱能轉化成化學能 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求書寫下列反應的方程式:
(1)NO2溶于水的化學反應方程式:__。
(2)實驗室制取氨氣的化學反應:__。
(3)乙醇與乙酸的酯化反應方程式:__。
(4)紅熱的碳和濃硝酸的化學反應方程式:__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分枝酸可用于生化研究。其結構簡式如圖。下列關于分枝酸的敘述正確的是

A. 分子中含有2種官能團
B. 可與乙醇、乙酸反應,且反應類型相同
C. 1mol分枝酸最多可與3molNaOH發生中和反應
D. 可使溴的四氯化碳溶液、酸性高錳酸鉀溶液褪色,且原理相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素W、X、Y、Z,它們在周期表中位置如圖所示,X的一種氫化物與其最高價氧化物對應水化物反應生成鹽。下列說法正確的是
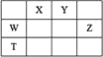
A.T元素單質具有半導體的特性,T與Y元素可形成兩種化合物TY和![]()
B.由Y、Z和氫三種元素形成的化合物中,Z的化合價越高氧化性越強
C.W的氧化物是酸性氧化物,能與堿、水反應,不能與酸反應
D.X的氫化物分子中所有原子均滿足8電子結構
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com