
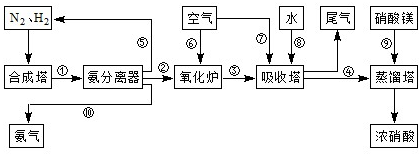
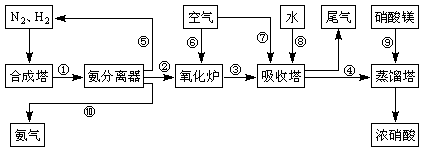
合成氨和制備硝酸是兩種重要的化工生產(chǎn),重慶某化工廠將合成氨與制備硝酸進行連續(xù)生產(chǎn)。
(1)在某溫度下體積為200 L的氨合成塔中,以分為單位的時間點上測得各物質(zhì)的濃度(mol·L﹣1)如下表:
|
|
0 min |
l min |
2 min |
3 min |
4 min |
|
N2 |
1.500 |
1.400 |
1.200 |
c1 |
c1 |
|
H2 |
4.500 |
4.200 |
3.600 |
c2 |
c2 |
|
NH3 |
0 |
0.200 |
0.600 |
c3 |
c3 |
根據(jù)表中數(shù)據(jù)得知0 min~2 min內(nèi)N2的平均反應速率是_______,若3 min末N2的轉化率為a,則此時H2的轉化率為_______ (用含a的代數(shù)式表示)。
(2)今對合成氨反應進行如下研究:在容積均為10 L的a、b、c三個相同密閉容器中分別充入1 mol N2和3 mol H2,三個容器的反應溫度分別為T1、T2、T3,在其他條件相同情況下,實驗測得反應均進行到5 min時,NH3的體積分數(shù)如圖所示。則下列說法正確的是_______。

A.a(chǎn)、b、C三容器5 min時的正反應速率大小為:b>a>c
B.達到平衡時,a、b、c中N2轉化率為a>b>c
C.5min時,a、b、c三容器中的反應均可能達到平衡狀態(tài)。
D.將容器b中的平衡狀態(tài)轉變到容器c中的平衡狀態(tài),可采取的措施有升溫或減壓
(3)已知:N2(g)+O2(g)=2NO(g): △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=﹣905 kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=﹣483.6 kJ/mol
則在該條件下,氨合成塔中所發(fā)生反應的熱化學方程式為:____________________________;
(4)金屬Cu單獨與氨水或單獨與雙氧水都不反應,但可與二者的混合溶液反應生成深藍色溶液,寫出該反應的離子方程式:_________________________________________;
(5)取200 mL的硝酸恰好與32 g Cu2S完全反應,已知硝酸被還原成等物質(zhì)的量的NO和NO2,另外還有CuSO4和Cu(NO3)2生成,則所得工業(yè)硝酸的濃度是_______mol·L﹣1。
(1)0.15mol·L-1·min (2分);a(2分)
(2)BD(2分)
(3)N2(g)+ 3H2(g) =2NH3(g) △H= ﹣92.4kJ/mol(3分)
(4)Cu+NH3·H2O+H2O2=[Cu(NH3)4]2+ +4H2O+OH-(3分)
(5)7(3分)
【解析】
試題分析:(1)根據(jù)表中數(shù)據(jù)可知,在2min內(nèi)N2的反應速率v(N2)= (1.5-1.2)mol·L﹣1 /2min=0.15 mol·L-1·min;起始時N2 : H2 =1:3,跟方程式的系數(shù)比相等,所以N2 、H2 的轉化率相等,均為a。
(2)如圖,三種溫度下反應到5min時,氨氣的體積分數(shù)不同,根據(jù)圖像呈現(xiàn)的趨勢,氨氣的體積分數(shù)隨溫度的升高先升后降,說明在T1 條件下的反應在5min時還沒有達到平衡,而在T3條件下反應5,min時已經(jīng)達到平衡,而且相比T2條件下的反應,升高溫度反應逆向移動,正反應為放熱:
A.溫度越高,反應速率越大,所以a、b、c三容器5min時的正反應反應速率大小為c > b > a,錯誤。
B.根據(jù)上述分析,正反應放熱反應,所以溫度越高,平衡逆向移動,平衡時候N2轉化率越低,所以a>b>c,B正確。
C.根據(jù)上述分析,a容器未達平衡,b、c達到平衡,C錯誤。
D.容器b要變成c的平衡狀態(tài),則平衡要逆向移動,則可采取升高溫度或者減小壓強的措施,D正確。
(3)利用蓋斯定律和已知方程式,由①-1/2②+3/2③可得合成氨的熱化學方程式為:N2(g)+ 3H2(g) =2NH3(g) △H= ﹣92.4kJ/mol。
(4) 金屬Cu與氨水和雙氧水的混合溶液反應生成深藍色溶液,發(fā)生了氧化還原反應,且生成了配合離子,可以類比銀氨溶液中的銀銨離子[Ag(NH3)2]2+ ,所以生成的配合離子為[Cu(NH3)4]2+ ,反應方程式為:Cu+NH3·H2O+H2O2=[Cu(NH3)4]2+ +4H2O+OH- 。
(5)根據(jù)題意得:n(Cu2S)= 32 g/160g/mol=0.2mol,硝酸與硫化亞銅反應,硝酸為氧化劑和酸,而Cu和S均被氧化,Cu由 +1→+2價, S由-2→+6價,所以失去的電子總數(shù)n(e-)= n(Cu)+8 n(S)=0.4mol+1.6mol=2mol,又n(CuSO4)= n(Cu(NO3)2)=0.2mol,所以作酸的部分硝酸n(HNO3)= 2n(Cu(NO3)2)=0.4mol,作氧化劑的硝酸化合價變化+5→+2價,+5→+4價,且n(NO)= n(NO2),所以的電子總數(shù)n(e-)= 3n(NO)+ n(NO2)=4 n(NO),得失電子守恒,所以有4 n(NO) =2mol,所以可得n(NO)= n(NO2)=0.5mol,所以作氧化劑的硝酸n(HNO3)= n(NO)+ n(NO2)=1mol,所以總的硝酸n(HNO3)= 0.4mol+1mol=1.4mol,所以硝酸的濃度c(HNO3)= 1.4mol /0.2 L=7mol/L。
考點:本題考查的是化學反應與能量、化學反應速率、化學平衡、氧化還原的計算等知識。


科目:高中化學 來源: 題型:閱讀理解
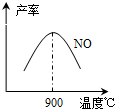 (3)NH3和O2在鉑系催化劑作用下從145℃就開始反應:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同溫度下NO產(chǎn)率如右圖所示.溫度高于900℃時,NO產(chǎn)率下降的原因
(3)NH3和O2在鉑系催化劑作用下從145℃就開始反應:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同溫度下NO產(chǎn)率如右圖所示.溫度高于900℃時,NO產(chǎn)率下降的原因查看答案和解析>>
科目:高中化學 來源: 題型:

| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年浙江省寧波市高三第二次模擬考試理綜化學試卷(解析版) 題型:填空題
工業(yè)合成氨與制備硝酸一般可連續(xù)生產(chǎn),流程如下:

請回答下列問題:
(1)某科研小組研究:在其他條件不變的情況下,改變起始物氫氣的物質(zhì)的量,對反應N2(g)+3H2(g) 2NH3(g)
ΔH=-92.4
kJ·mol-1的影響。實驗結果如圖所示:(圖中T表示溫度,n表示物質(zhì)的量)
2NH3(g)
ΔH=-92.4
kJ·mol-1的影響。實驗結果如圖所示:(圖中T表示溫度,n表示物質(zhì)的量)

①圖像中T2和T1的關系是:T2 T1(填“>”、“<”、“=”或“無法確定”)。
②比較在a、b、c三點所處的平衡狀態(tài)中,N2的轉化率最高的是 (填字母)。
③要使反應后氨的百分含量最大,則在起始體系中原料投料比n(H2)/n(N2) 3(填 “>”、“<”、“=”或“無法確定”)。若容器容積恒為1 L,起始狀態(tài)n(H2)=3 mol,反應達到平衡時H2的轉化率為60%,則此條件下(T2),反應的平衡常數(shù)K= 。(結果保留小數(shù)點后兩位)
(2)已知:N2(g)+O2(g) 2NO(g) ΔH=+180.5 kJ·mol-1
2NO(g) ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
今有17 g氨氣,假設其經(jīng)催化氧化完全反應,生成一氧化氮氣體和水蒸氣,則該過程中所放出的熱量為 kJ。
(3)在裝置②中,NH3和O2從145℃就開始下列反應,在不同溫度和催化劑條件下生成不同產(chǎn)物(如下圖所示):

溫度較低時生成 為主,溫度高于900℃時,NO產(chǎn)率下降的可能原因是 。
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
工業(yè)合成氨與制備硝酸一般可連續(xù)生產(chǎn),流程如下:
(1)工業(yè)生產(chǎn)時,制取氫氣的一個反應為:CO+H2O(g)![]() CO2+H2
CO2+H2
①t℃時,往1L密閉容器中充入0.2mol CO和0.3mol水蒸氣。反應建立平衡后,體系中c(H2)=0.12mol·L-1。該溫度下此反應的平衡常數(shù)K=_____(填計算結果)。
②保持溫度不變,向上述平衡體系中再加入0.1molCO,當反應重新建立平衡時,水蒸氣的轉化率α(H2O)=________。

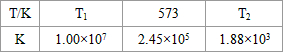
(2)合成塔中發(fā)生反應N2(g)+3H2(g)![]() 2NH3(g);△H<0。下表為不同溫度下該反應的平衡常數(shù)。由此可推知,表中
2NH3(g);△H<0。下表為不同溫度下該反應的平衡常數(shù)。由此可推知,表中
T1____573K(填“>”、“<”或“=”)。
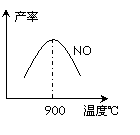
(3)NH3和O2在鉑系催化劑作用下從145℃就開始反應:
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同溫度下NO產(chǎn)率如圖所示。溫度高于900℃時,
NO產(chǎn)率下降的原因 。
(4)廢水中的N、P元素是造成水體富營養(yǎng)化的關鍵因素,農(nóng)藥廠排放的廢水中常含有較多的NH4+和PO43-,一般可以通過兩種方法將其除去。
①方法一:將Ca(OH)2或CaO 投加到待處理的廢水中,生成磷酸鈣,從而進行回收。當處理后的廢水中c(Ca2+)=2×10-7 mol/L時,溶液中c(PO43-)= mol/L。
(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在廢水中加入鎂礦工業(yè)廢水,就可以生成高品位的磷礦石―鳥糞石,反應的方程式為Mg2++NH4++PO43-=MgNH4PO4↓。該方法中需要控制污水的pH為7.5~10,若pH高于10.7,鳥糞石的產(chǎn)量會大大降低。其原因可能為 。與方法一相比,方法二的優(yōu)點為 。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com