
【題目】(1)質量比為16∶7∶6的三種氣體SO2、CO、NO,分子個數之比為_____________;氧原子個數之比為____________。
(2)在標準狀況下,6.8g PH3與標準狀況下_______L CH4含有相同數目的H原子。
(3)某氣體氧化物化學式為RO2,在標準狀況下,1.28 g該氧化物的體積為448 mL,則該氧化物的摩爾質量為________,R的相對原子質量為________。
(4)273 K、1.01×105 Pa時氣態單質X2的密度為1.25 g·L-1,則X的相對原子質量為________
(5)相同溫度和壓強條件下,一定體積的氣態氫化物H2R的質量是等體積NH3的2倍,則R的相對原子質量為____________。
【答案】5:5:4 10:5:4 3.36 64g.mol-1 32 14 32
【解析】
(1)根據n=![]() 計算SO2、CO、NO的物質的量之比,分子數目之比等于其物質的量之比,結合分子式計算含有氧原子數目之比;
計算SO2、CO、NO的物質的量之比,分子數目之比等于其物質的量之比,結合分子式計算含有氧原子數目之比;
(2)依據n=![]() =
=![]() =
=![]() ,結合PH3含有3個H,CH4含有4個H解答;
,結合PH3含有3個H,CH4含有4個H解答;
(3)根據n=![]() 計算RO2的物質的量,再根據M=
計算RO2的物質的量,再根據M=![]() 計算其摩爾質量,進而計算R的相對原子質量;
計算其摩爾質量,進而計算R的相對原子質量;
(4)依據ρ標=![]() 計算M,然后計算X的相對原子質量;
計算M,然后計算X的相對原子質量;
(5)相同狀態下,氣體摩爾體積相等,相同體積的不同氣體其物質的量相等,根據m=nM計算X的摩爾質量。
(1)質量比為16∶7∶6的三種氣體 SO2、CO、NO物質的量之比為![]() ∶
∶![]() ∶
∶![]() =5∶5∶4,故三者分子數目之比為5∶5∶4,含有氧原子數目之比為5×2∶5×1∶4×1=10∶5∶4,故答案為:5∶5∶4;10∶5∶4;
=5∶5∶4,故三者分子數目之比為5∶5∶4,含有氧原子數目之比為5×2∶5×1∶4×1=10∶5∶4,故答案為:5∶5∶4;10∶5∶4;
(2)依據n=![]() =
=![]() =
=![]() ,要使二者含有氫原子數相等則滿足:
,要使二者含有氫原子數相等則滿足:![]() ×3=
×3=![]() ×4,解得V=3.36L,故答案為:3.36;
×4,解得V=3.36L,故答案為:3.36;
(3)RO2的物質的量為![]() =0.02mol,其摩爾質量為
=0.02mol,其摩爾質量為![]() =64g/mol,R的相對原子質量為64-32=32,故答案為:64g/mol;32;
=64g/mol,R的相對原子質量為64-32=32,故答案為:64g/mol;32;
(4)273K、1.01×105Pa時氣態單質X2的密度為1.25gL-1,則M=ρ標×22.4L/mol=1.25gL-1×22.4L/mol=28g/mol;則X的相對原子質量為![]() =14,故答案為:14;
=14,故答案為:14;
(5)相同狀態下,氣體摩爾體積相等,相同體積的不同氣體其物質量相等,根據m=nM知,相同物質的量時氣體質量與摩爾質量成正比,相同狀況下,一定體積的氣態氫化物H2R的質量是等體積NH3的2倍,則H2R的摩爾質量是氨氣的2倍,為34g/mol,則R摩爾質量=(34-2)g/mol=32g/mol,相對原子質量為32,故答案為:32。


科目:高中化學 來源: 題型:
【題目】已知某“84”消毒液瓶體部分標簽如圖所示,該“84 消毒液通常稀釋100 倍(體積之比)后使用。請回答下列問題:

(1)“84消毒液的物質的量濃度約為_______(保留一位小數molL-1)
(2)某同學取20mL該“84"消毒液,稀釋后用于消毒,稀釋后的溶液中c(Na+)=______mol
(3)“84”消毒液與稀硫酸混合使用可增強消毒能力,某消毒小組人員用98%(密度為1.8gcm-3)的濃硫酸配制1L3.6mo1L-1稀硫酸用于增強“84”消毒液的消毒能力。需用濃硫酸的體積為______mL;配制該溶液需要的儀器有玻璃棒、燒杯、量筒和_______(填玻璃儀器名稱)
(4)若配制3.6mol/L的硫酸溶液的其他操作均正確,但出現下列錯誤操作,將使 所配制的硫酸溶液濃度偏低的是_______(填字母代號,多選題,少選不給分)
A.將稀釋的硫酸溶液轉移至容量瓶后,未洗滌燒杯和玻璃棒
B.稀釋過程中,溶液未經冷卻就轉移至容量瓶
C.所用濃硫酸長時間放置在密封不好的容器中
D.用膠頭滴管向容量瓶中加水時,俯視觀察溶液凹液面與容量瓶刻度相切
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容密閉容器中發生反應2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)。在323K和343K時SiHCl3的轉化率隨時間變化的結果如圖所示。下列說法正確的是( )

A. 323 K時,縮小容器體積可提高SiHCl3的轉化率
B. a、b點對應的反應速率大小關系:v(a)<v(b)
C. 343 K時,上述反應的化學平衡常數約為0.02
D. 2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)的正反應為吸熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常用鹽酸的質量分數為36.5%,密度為1.20 g·mL-1。
(1)此濃鹽酸中HCl的物質的量濃度是________。
(2)配制100 mL該濃鹽酸,需要標準狀況下HCl的體積為________。
(3)配制100 mL 3.00 mol·L-1的鹽酸,需以上濃鹽酸的體積為________。
(4)將10.0 mL 3.00 mol·L-1的鹽酸與10.0 mL 1.00 mol·L-1的MgCl2溶液混合,則混合溶液中Cl-的物質的量濃度是________。(設混合后溶液的體積不變)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇作為基本的有機化工產品和環保動力燃料具有廣闊的應用前景,CO2加氫合成甲醇是合理利用CO2的有效途徑。由CO2制備甲醇過程可能涉及反應如下:
反應Ⅰ:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反應Ⅱ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反應Ⅲ:CO2(g)+3H2g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列問題:
(1)反應Ⅰ、Ⅱ、Ⅲ的化學平衡常數分別為K1、K2、K3、則K3=__________(用K的代數式表示)
(2)在恒壓密閉容器中,充入一定量的 H2 和 CO2(假定僅發生反應Ⅲ),實驗測得反應物在不同溫度下,反應體系中 CO2 的平衡轉化率與壓強的關系曲線如圖 1 所示。

①比較 T1 與 T2 的大小關系:T1____________T2(填“<”、“=”或“>”)
②在 T1 和 p6 的條件下,往密閉容器中充入 3 mol H2 和 1 mol CO2,該反應在第 5 min 時達到平衡,此時容器的體積為 1.8 L,則該反應在此溫度下的平衡常數為________。
a.若此條件下反應至 3 min 時刻,改變條件并于 A 點處達到平衡,CH3OH 的濃度隨反應時間的變化趨勢如圖 2所示(3~4 min 的濃度變化未表示出來),則改變的條件為 __________,請用 H2 的濃度變化計算從4 min開始到 A點的反應速率v(H2)= _________(保留兩位小數)。
b.若溫度不變,壓強恒定在 p8 的條件下重新達到平衡時,容器的體積變為_______L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應屬于非氧化還原反應的是( )
A. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
B. NH4NO3![]() N2O↑十2H2O
N2O↑十2H2O
C. 2FeCl2+Cl2=2FeCl3
D. Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣里含有的NO氣體是由于內燃機燃燒的高溫引起氮氣和氧氣反應:N2(g)+O2(g)![]() 2NO(g)ΔH >0,已知該反應在240℃,平衡常數K=64×10-4。請回答:
2NO(g)ΔH >0,已知該反應在240℃,平衡常數K=64×10-4。請回答:
(1)某溫度下,向2 L的密閉容器中充入N2和O2各1 mol,5分鐘后O2的物質的量為0.5 mol,則N2的反應速率為_____________________。
(2)假定該反應是在恒容條件下進行,判斷該反應達到平衡的標志________ 。
A.消耗1 mol N2同時生成1 mol O2
B.混合氣體密度不變
C.混合氣體平均相對分子質量不變
D.2v正(N2)=v逆(NO)
(3)將N2、O2的混合氣體充入恒溫恒容密閉容器中,下圖變化趨勢正確的是____________(填字母序號)。

(4)向恒溫恒容的密閉容器中充入等物質的量的N2和O2,達到平衡狀態后再向其中充入一定量NO,重新達到化學平衡狀態。與原平衡狀態相比,此時平衡混合氣中NO的體積分數________。(填“變大”、“變小”或“不變”)
(5)該溫度下,某時刻測得容器內N2、O2、NO的濃度分別為2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此時反應___________________(填“處于化學平衡狀態”、“向正反應方向進行”或“向逆反應方向進行”),理由是________________________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某“84消毒液”瓶體部分標簽如圖所示,該“84消毒液”通常稀釋100倍(體積之比)后使用。請回答下列問題:
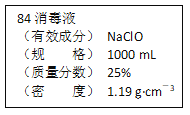
(1)該“84消毒液”的物質的量濃度約為_____mol·L-1。
(2)取用任意體積的該鹽溶液時,下列物理量中會隨所取體積的多少而變化的是________(填字母)。
A.溶液中NaClO的物質的量 B.溶液的濃度
C.溶液中NaClO的摩爾質量 D.溶液的密度
(3)該同學參閱該“84消毒液”的配方,欲用NaClO固體配制480 mL含NaClO質量分數為25%的消毒液。回答下列問題。
①如圖所示的儀器中,有些是不需要,配制上述溶液還需要玻璃儀器_______

②需要稱量NaClO固體的質量為_______ g
(4)“84消毒液”與稀硫酸混合使用可增強消毒能力,某消毒小組人員用98%(密度為1.84 g·cm-3)的濃硫酸配制200 mL 2.3 mol·L-1的稀硫酸用于增強“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物質的量濃度為________mol·L-1。
②需用濃硫酸的體積為________ mL。
③若所配制的稀硫酸濃度偏小,則下列可能的原因分析中正確的是_______。
A.配制前,容量瓶中有少量蒸餾水 B.量取濃硫酸時,仰視液體的凹液面
C.未冷卻,立即轉移至容量瓶定容 D.定容時,仰視溶液的凹液面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】前四周期的A、B、C、D四種元素在周期表中均與元素X緊密相鄰。已知元素X最高價氧化物的化學式為X2O5,B、D同主族且B元素的原子半徑是同族元素中最小的,C的最高價氧化物對應的水化物是強酸。
(1)D元素基態原子的外圍電子排布式為____________________。
(2)A、C、X三種元素原子的第一電離能由大到小的順序為________________(用相應的元素符號作答)。
(3)B、X、D氫化物的沸點由高到低的順序為_______________(用相應的化學式作答)。
(4)C元素的原子可形成多種離子,試推測下列微粒的立體構型(C為字母,不是碳元素):
微粒 | CO32- | CO42- |
立體構型名稱 | _______________ | _______________ |
(5)元素B的一種氫化物B2H4具有重要的用途。有關B2H4的說法正確的是_______。
A.B2H4分子間可形成氫鍵 B.B原子是sp3雜化
C.B2H4分子中含有5個σ鍵和1個π鍵 D.B2H4晶體變為液態時破壞共價鍵
(6)E元素和D元素在同一周期,屬于VIII族,價層有三個單電子,E(OH)2為兩性氫氧化物,在濃的強堿溶液中可形成E(OH)42-,寫出E(OH)2酸式電離的電離方程式___________________。
(7)F元素基態原子M層上有5對成對電子,F形成的單質有δ、γ、α三種同素異形體,三種晶胞(如圖所示)中F原子的配位數之比為___________,δ、γ、α三種晶胞的邊長之比為_____________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com