
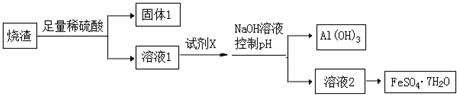
分析 硫鐵礦焙燒取硫后的燒渣(主要成分為Fe2O3、SiO2、Al2O3,不考慮其他雜質)中加入足量稀硫酸,發生的反應有Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Al2O3+3H2SO4=Al2(SO4)3+3H2O,SiO2不溶于稀硫酸,然后過濾,得到的固體1成分為SiO2,濾液1中含有Fe2(SO4)3、H2O、Al2(SO4)3;在濾液1中加入X,然后加入NaOH溶液并調節溶液的pH,得到沉淀Al(OH)3 和溶液2,從溶液2中能得到FeSO4•7H2O晶體,說明溶液2中溶質為FeSO4,則X具有還原性,能將Fe3+氧化為Fe2+,且不能引進新的雜質,則X為Fe,加入試劑X發生的離子反應有2 Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑,將溶液2蒸發濃縮、冷卻結晶、過濾得到FeSO4•7H2O晶體,據此分析解答.
解答 解:硫鐵礦焙燒取硫后的燒渣(主要成分為Fe2O3、SiO2、Al2O3,不考慮其他雜質)中加入足量稀硫酸,發生的反應有Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Al2O3+3H2SO4=Al2(SO4)3+3H2O,SiO2不溶于稀硫酸,然后過濾,得到的固體1成分為SiO2,濾液1中含有Fe2(SO4)3、H2O、Al2(SO4)3;在濾液1中加入X,然后加入NaOH溶液并調節溶液的pH,得到沉淀Al(OH)3 和溶液2,從溶液2中能得到FeSO4•7H2O晶體,說明溶液2中溶質為FeSO4,則X具有還原性,能將Fe3+氧化為Fe2+,且不能引進新的雜質,則X為Fe,加入試劑X發生的離子反應有2 Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑,將溶液2蒸發濃縮、冷卻結晶、過濾得到FeSO4•7H2O晶體,
(1)通過以上分析知,固體1為難溶于稀硫酸的SiO2,故答案為:SiO2;
(2)通過以上分析知,X為Fe,試劑X與溶液1發生的離子反應為2 Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑,
故答案為:Fe;2 Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑;
(3)從溶液中獲取晶體的操作是蒸發濃縮、冷卻結晶、過濾、洗滌、干燥,故答案為:冷卻結晶;過濾.
點評 本題考查物質分離和提純,為高頻考點,側重考查學生分析推斷及基本操作能力,明確物質性質及流程圖中可能發生的反應、基本操作方法是解本題關鍵,注意X與溶液1的反應中還有稀硫酸與Fe的反應,為易錯點.


科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
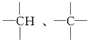 中的碳原子分別稱為伯、仲、叔、季碳原子,數目分別用n1、n2、n3、n4表示,則烷烴(除甲烷外)中存在的關系有:(用以上符號回答)
中的碳原子分別稱為伯、仲、叔、季碳原子,數目分別用n1、n2、n3、n4表示,則烷烴(除甲烷外)中存在的關系有:(用以上符號回答)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K值不變,平衡一定不移動 | B. | K值變化,平衡一定移動 | ||
| C. | 平衡移動,K值一定變化 | D. | 平衡移動,K值一定不變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
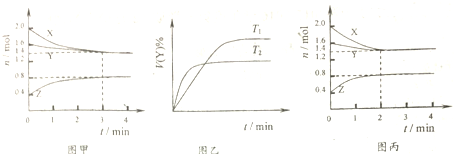
| A. | T1℃時,容器中發生的反應可表示為:3X(g)+Y(g)?2Z(g),且正反應放熱 | |
| B. | T1℃時,反應進行的前3min內,用X表示的反應速率v(X)=0.2mol•(L•min)-1 | |
| C. | T1℃時,3min達到平衡后,向容器中再加入2.0mol X、1.6mol Y、0.4mol Z,反應達到新平衡時:0.7mol•L-1<c(Y)<1.4mol•L-1 | |
| D. | 若改變反應條件,使反應進程如圖丙所示,則改變的條件是使用催化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
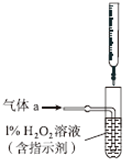 硫酸工業產生的廢氣(主要成分:SO2、O2、N2、CO2等)排放到空氣中會污染環境.某化學興趣小組對廢氣的組成進行探究,請回答下列問題:
硫酸工業產生的廢氣(主要成分:SO2、O2、N2、CO2等)排放到空氣中會污染環境.某化學興趣小組對廢氣的組成進行探究,請回答下列問題:
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

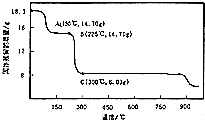
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 步驟 | 操作 | 現象及結論 |
| 1 | 用甲、乙兩支試管分別取兩種溶液各少許. | |
| 2 | 用膠頭滴管向甲試管中逐滴滴加BaCl2溶液至過量. | |
| 3 | 靜置,將甲中上層清液注入乙中 | 若產生白色沉淀,則甲是Na2SO3溶液,乙是稀H2SO4. 若乙試管中沉淀溶解且放出有刺激性氣味的氣體,則甲是稀H2SO4,乙是Na2SO3溶液. |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com