


分析 (1)調節溶液pH為堿性環境,以除去溶液中Al3+和Fe3+,可以使之轉化為氫氧化物沉淀而除去,根據保證不引入雜質離子來選擇合適的調節pH值的試劑;
(2)根據蒸發操作所需儀器來回答;
(3)根據溫度過高會導致實驗誤差來回答;
(4)①根據氣壓原理來判斷裝置的氣密性情況;
②根據實驗原理,保證碳酸鈣和鹽酸反應產生的二氧化碳的放出是關鍵;
③碳酸鈣和鹽酸反應產生的二氧化碳的量不能受外界空氣中二氧化碳和水的干擾;
④根據實驗的原理結合化學反應進行計算即可.
解答 解:(1)調節溶液pH為堿性環境,以除去溶液中Al3+和Fe3+,可以使之轉化為氫氧化物沉淀而除去濾渣的主要成分是氫氧化鋁和氫氧化鐵,為了保證不引入雜質離子,所以中和鹽酸的酸性調節pH值可以用氧化鈣或是碳酸鈣,故答案為:Fe(OH)3、Al(OH)3;AB;
(2)根據蒸發操作所需儀器有玻璃棒、蒸發皿、酒精燈、三腳架,故答案為:玻璃棒和蒸發皿;
(3)根據溫度過高會導致雙氧水分解,引起實驗誤差,故答案為:溫度過高會導致雙氧水分解;
(4)①根據氣壓原理來判斷裝置的氣密性,方法是關閉導管出口以及分液漏斗的瓶塞,打開分液漏斗的旋塞,液體不往下滴,證明氣密性良好,故答案為:關閉導管出口以及分液漏斗的瓶塞,打開分液漏斗的旋塞,液體不往下滴,證明氣密性良好;
②根據實驗原理,保證碳酸鈣和鹽酸反應產生的二氧化碳的放出是關鍵,所以從A裝置通入空氣,目的是保證碳酸鈣和鹽酸反應產生的二氧化碳全部進入下一個裝置,故答案為:讓生成的二氧化碳全部放出,進入C裝置,確保實驗結果的準確性;
③碳酸鈣和鹽酸反應產生的二氧化碳的量不能受外界空氣中二氧化碳和水的干擾,裝置D的作用為防止空氣中的二氧化碳進入裝置C中,引起實驗誤差,故答案為:防止空氣中的二氧化碳進入裝置C中,引起實驗誤差;
④根據碳酸鈣中碳元素守恒,碳酸鈣中的碳元素先成為二氧化碳,然后是二氧化碳在和氫氧化鋇反應得到碳酸鋇沉淀,碳酸鋇中的碳元素全部來自碳酸鈣中,所以17.73gBaCO3沉淀的物質的量為17.73g÷197g•mol-1=0.09mol,所以碳酸鈣的物質的量是0.09mol,質量是9g,百分含量是9g÷10.00g×100%=90.00%,故答案為:90.00%.
點評 本題是以制備過氧化鈣為載體,考查實驗的設計與評價,涉及實驗的基本操作和實驗原理的理解,要求學生具有分析和解決問題的能力,難度大.


科目:高中化學 來源: 題型:解答題
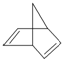 ,其分子式為C7H8.
,其分子式為C7H8. .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
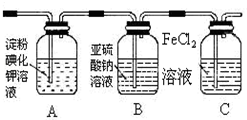
| 實驗步驟 | 預期現象和結論 |
步驟1:取適量洗氣瓶B中溶液于試管A中,滴加過量2mol/LHCl和1mol/LBaCl2溶液 振蕩. | 若產生的白色沉淀,則洗氣瓶B溶液中存在SO42- |
步驟2:另取適量洗氣瓶B中溶液于試管B中,滴加滴加入過量lmol/LBa(NO3)2溶液 振蕩,靜置. | 產生白色沉淀. |
步驟3:取步驟2后試管B中的上層清液于試管C中, 滴加0.1mol/LAgNO3溶液和過量的2mol/LHNO3,振蕩.. | 若產生白色沉淀,則洗氣瓶B溶液中存在氯離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 核外有25個電子 | |
| B. | 是一種新元素 | |
| C. | 核內有15個質子,核外有10個電子 | |
| D. | 質量數為25,原子序數為15,核內有10個中子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | PH<7的溶液:Cu2+、Na+、Mg2+、NO3- | |
| B. | 滴加酚酞試液顯紅色的溶液:Fe3+、NH4+、Cl-、NO3- | |
| C. | 所含溶質為NaOH的溶液中:K+、SO42-、NO3-、H+ | |
| D. | 在堿性溶液:K+、HCO3-、Br-、Ba2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 按系統命名法, 的名稱為2,5,6-三甲基-4-乙基庚烷 的名稱為2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常壓下,正戊烷、異戊烷、新戊烷的沸點依次增大 | |
| C. | 分子是為C5H12O且可與金屬鈉反應放出氫氣的有機物有 (不考慮立體異構) 8種 | |
| D. | 某單炔烴,氫化后的產物結構簡式為: ,則該烴可能有的結構有4種 ,則該烴可能有的結構有4種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
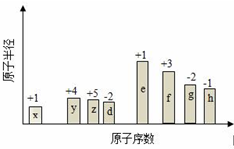 隨原子序數的遞增,八種短周期元素(用字母X表示)原子半徑的相對大小、最高正價或最低負價的變化如圖所示.
隨原子序數的遞增,八種短周期元素(用字母X表示)原子半徑的相對大小、最高正價或最低負價的變化如圖所示.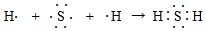 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 香精里面含有酯類物質,工業上以A為主要原料來合成酯C4H8O2,其合成路線如圖所示.其中A是石油裂解氣的主要成份,A的產量通常用來衡量一個國家的石油化工水平.又知2CH3CHO+O2$→_{△}^{催化劑}$2CH3COOH.
香精里面含有酯類物質,工業上以A為主要原料來合成酯C4H8O2,其合成路線如圖所示.其中A是石油裂解氣的主要成份,A的產量通常用來衡量一個國家的石油化工水平.又知2CH3CHO+O2$→_{△}^{催化劑}$2CH3COOH.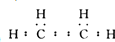
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.15mol•L-1•min-1 | B. | 0.3mol•L-1•min-1 | ||
| C. | 0.45mol•L-1•min-1 | D. | 0.6mol•L-1•min-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com