
一氧化碳與水蒸氣的反應為www..comCO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
在密閉容器中,將1.0 mol CO與1.0mol H2O混合加熱到434℃,在434℃的平衡常數K1 =9
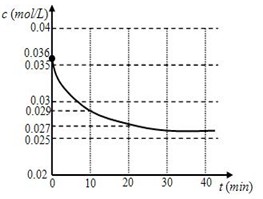
(1)跟蹤測定H2O的物質的量濃度,如圖所示,則0 —20 min ,H2O的反應速率是
(2)請在圖中用實線繪制出在該溫度下加入正催化劑后,H2O的物質的量濃度變化圖線。
(3)從434℃升溫至800℃,800℃的平衡常數K2 =1,則正反應為_____________(填“放
熱反應”或“吸熱反應”或“不能確定”)。
(4)求在800℃反應達平衡時,CO轉化為CO2的轉化率(寫出必要的計算過程)
科目:高中化學 來源:2012-2013學年江蘇泰州二中高二上學期期中考試化學(選修)試卷(帶解析) 題型:填空題
(12分)Ⅰ.煤燃燒的反應熱可通過以下兩個途徑來利用:a. 利用煤在充足的空氣中直接燃燒產生的反應熱;b. 先使煤與水蒸氣反應得到氫氣和一氧化碳,然后使得到的氫氣和一氧化碳在充足的空氣中燃燒。這兩個過程的熱化學方程式為:
C(s)+O2(g)=CO2(g); ΔH=E1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g)=H2O(g); ΔH=E3 ③
CO(g)+1/2O2(g)=CO2(g); ΔH=E4 ④,
試回答下列問題
(1)與途徑a相比,途徑b有較多的優點,即 。
(2)上述四個熱化學方程式中ΔH>0的反應有 。
(3)等質量的煤分別通過以上兩條不同途徑產生的可利用的總能量關系正確的是 。
| A.a比b多 | B.a比b少 | C. a與b在理論上相同 | D.兩者無法比較 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年湖北武漢市武昌區高三上學期期末考試理綜化學試卷(解析版) 題型:填空題
能源是制約國家發展進程的因素之一。甲醇、二甲醚等被稱為2 1世紀的綠色能源,工業上利用天然氣為主要原料與二氧化碳、水蒸氣在一定條件下制備合成氣(CO、H2),再制成甲醇、二甲醚。
(1)工業上,可以分離合成氣中的氫氣,用于合成氨,常用醋酸二氨合亞銅
[Cu(NH3)2Ac]溶液(Ac=CH3COO-)(來吸收合成氣中的一氧化碳,其反虛原理為:
[Cu(NH3)2Ac](aq)+CO+NH3 [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)
常壓下,將吸收一氧化碳的溶液處理重新獲得[Cu(NH3)2]AC溶液的措施是 ;
(2)工業上一般采用下列兩種反應合成甲醇:
反應a:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反應b:CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
①對于反應a,某溫度下,將4.0 mol CO2(g)和12.0 mol H2(g)充入容積為2L的密閉容器中,反應到達平衡時,測得甲醇蒸氣的體積分數為30%,則該溫度下反應的平衡常數為 ;
②對于反應b,某溫度下,將1.0mol CO(g)和2.0 mol H2(曲充入固定容積的密閉容器中,反應到達平衡時,改變溫度和壓強,平衡體系中CH3OH的物質的量分數變化情況如圖所示,溫度和壓強的關系判斷正確的是 ;(填字母代號)

A.p3>p2,T3>T2
B.p2>p4,T4>T2
C.p1>p3,T1>T3
D.p1>p4,T2>T3
(3)CO可以合成二甲醚,二甲醚可以作為燃料電池的原料,化學反應原理為:
CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0
①在恒容密閉容器里按體積比為1:4充入一氧化碳和氫氣,一定條件下反應達到平衡狀態。當改變反應的某一個條件后,下列變化能說明平衡一定向正反應方向移動的是 ;
A.逆反應速率先增大后減小
B.正反應速率先增大后減小
C.反應物的體積百分含量減小
D.化學平衡常數K值增大
②寫出二甲醚堿性燃料電池的負極電極反應式 ;
③己知參與電極反應的電極材料單位質量放出電能的大小稱為該電池的比能量。關于二甲醚堿性燃料電池與乙醇堿性燃料電池,下列說法正確的是 (填字母)
A.兩種燃料互為同分異構體,分子式和摩爾質量相同,比能量相同
B.兩種燃料所含共價鍵數目相同,斷鍵時所需能量相同,比能量相同
C.兩種燃料所含共價鍵類型不同,斷鍵時所需能量不同,比能量不同
(4)已知l g二甲醚氣體完全燃燒生成穩定的氧化物放出的熱量為31.63 kJ,請寫出表示二甲醚燃燒熱的熱化學方程式 。
查看答案和解析>>
科目:高中化學 來源:2014屆江蘇泰州二中高二上學期期中考試化學(選修)試卷(解析版) 題型:填空題
(12分)Ⅰ.煤燃燒的反應熱可通過以下兩個途徑來利用:a. 利用煤在充足的空氣中直接燃燒產生的反應熱;b. 先使煤與水蒸氣反應得到氫氣和一氧化碳,然后使得到的氫氣和一氧化碳在充足的空氣中燃燒。這兩個過程的熱化學方程式為:
C(s)+O2(g)=CO2(g); ΔH=E1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g)=H2O(g); ΔH=E3 ③
CO(g)+1/2O2(g)=CO2(g); ΔH=E4 ④,
試回答下列問題
(1)與途徑a相比,途徑b有較多的優點,即 。
(2)上述四個熱化學方程式中ΔH>0的反應有 。
(3)等質量的煤分別通過以上兩條不同途徑產生的可利用的總能量關系正確的是 。
A.a比b多 B. a比b少 C. a與b在理論上相同 D. 兩者無法比較
Ⅱ.氫氣是一種清潔能源,氫氣的制取與儲存是氫能源利用領域的研究熱點。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
以甲烷為原料制取氫氣是工業上常用的制氫方法。CH4(g)與H2O(g)反應生成CO2(g)和H2(g)的熱化學方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Ⅰ.煤燃燒的反應熱可通過以下兩個途徑來利用:a. 利用煤在充足的空氣中直接燃燒產生的反應熱;b. 先使煤與水蒸氣反應得到氫氣和一氧化碳,然后使得到的氫氣和一氧化碳在充足的空氣中燃燒。這兩個過程的熱化學方程式為:
C(s)+O2(g)=CO2(g); ΔH=E1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g)=H2O(g); ΔH=E3 ③
CO(g)+1/2O2(g)=CO2(g); ΔH=E4 ④,
試回答下列問題
(1)與途徑a相比,途徑b有較多的優點,即________。
(2)上述四個熱化學方程式中ΔH>0的反應有________。
(3)等質量的煤分別通過以上兩條不同途徑產生的可利用的總能量關系正確的是________。
| A.a比b多 | B.a比b少 | C. a與b在理論上相同 | D.兩者無法比較 |
Ⅱ.氫氣是一種清潔能源,氫氣的制取與儲存是氫能源利用領域的研究熱點。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
以甲烷為原料制取氫氣是工業上常用的制氫方法。CH4(g)與H2O(g)反應生成CO2(g)和H2(g)的熱化學方程式為________。
查看答案和解析>>
科目:高中化學 來源:0118 同步題 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com