
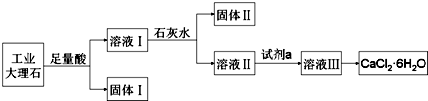
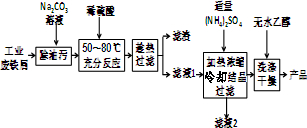
| A. | 固體Ⅰ中含有SiO2,固體Ⅱ中含有Fe(OH)3 | |
| B. | 使用石灰水時,要控制pH,防止固體Ⅱ中Al(OH)3轉化為AlO2- | |
| C. | 試劑a選用鹽酸,從溶液Ⅲ得到CaCl2•6H2O產品的過程中,須控制條件防止其分解 | |
| D. | 若改變實驗方案,在溶液Ⅰ中直接加氨水至沉淀完全,濾去沉淀,其溶液經蒸發濃縮、冷卻結晶也可得到純凈CaCl2•6H2O |
分析 工業大理石(含有少量SiO2、Al2O3、Fe2O3等雜質)加足量的鹽酸,得到二氧化硅沉淀和氯化鈣、氯化鋁、氯化鐵混合溶液,所以固體Ⅰ中含有SiO2,濾液中加石灰水,控制pH,可以得到Al(OH)3、Fe(OH)3沉淀,即為固體Ⅱ,過濾,得濾液再鹽酸中各過量的氫氧化鈣,得氯化鈣溶液,CaCl2•6H2O易分解,所以從溶液中獲得氯化鈣晶體時,要防止其分解,據此答題.
解答 解:工業大理石(含有少量SiO2、Al2O3、Fe2O3等雜質)加足量的鹽酸,得到二氧化硅沉淀和氯化鈣、氯化鋁、氯化鐵混合溶液,所以固體Ⅰ中含有SiO2,濾液中加石灰水,控制pH,可以得到Al(OH)3、Fe(OH)3沉淀,即為固體Ⅱ,過濾,得濾液再鹽酸中各過量的氫氧化鈣,得氯化鈣溶液,CaCl2•6H2O易分解,所以從溶液中獲得氯化鈣晶體時,要防止其分解,
A、根據上面的分析可知,固體Ⅰ中含有SiO2,固體Ⅱ中含有Fe(OH)3,故A正確;
B、氫氧化鋁具有兩性,可溶于氫氧化鈣溶液,生成AlO2-,故B正確;
C、CaCl2•6H2O易分解,所以從溶液中獲得氯化鈣晶體時,要防止其分解,故C正確;
D、若改變實驗方案,在溶液Ⅰ中直接加氨水至沉淀完全,濾去沉淀,其溶液中含有氯化銨,經蒸發濃縮、冷卻結晶得到的CaCl2•6H2O不純,故D錯誤;
故選D.
點評 本題考查制備實驗方案的設計與評價、工藝流程的分析應用,題目難度中等,側重學生分析能力和創新能力的培養,注意把握常見物質的分離方法.


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:解答題
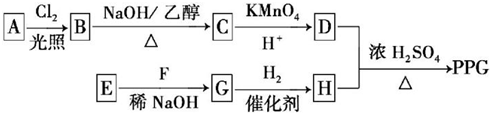
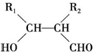 .
. .
. ,反應類型為消去反應.
,反應類型為消去反應. .
. (寫結構簡式);D的所有同分異構體在下列一種表征儀器中顯示的信號(或數據)完全相同,該儀器是c(填標號).
(寫結構簡式);D的所有同分異構體在下列一種表征儀器中顯示的信號(或數據)完全相同,該儀器是c(填標號).查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
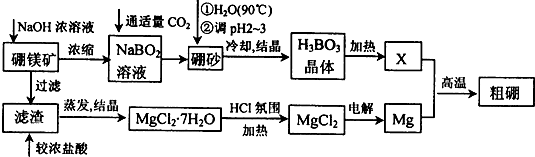
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平衡常數K=$\frac{8}{3}$ | |
| B. | 達到平衡后NO2和SO2的轉化率相等 | |
| C. | SO3和NO的體積比保持不變可以證明達到平衡狀態 | |
| D. | 每消耗1molSO3的同時生成1molNO2可以證明達到平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度、溶解度、物質 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亞鐵銨晶體 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
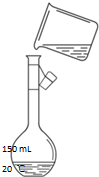 實驗室用氯化鈉固體配制1.00mol/L的NaCl溶液100mL,回答下列問題:
實驗室用氯化鈉固體配制1.00mol/L的NaCl溶液100mL,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
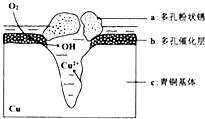 銅是一種重要的有色金屬,近年來用途越來越廣泛.請回答下列問題:
銅是一種重要的有色金屬,近年來用途越來越廣泛.請回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com