
 .②寫出反應Ⅰ的化學方程式4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O.
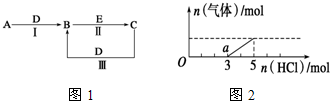
.②寫出反應Ⅰ的化學方程式4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O.分析 (1)A是能使濕的紅色石蕊試紙變藍的氣體,為NH3;C、D均為空氣的主要成分,為N2、O2,由轉化關系A$\stackrel{D}{→}$B,故D為O2,B為NO,C為N2,E是一種有毒氣體,結合轉化關系NO$\stackrel{E}{→}$N2,E具有還原性,為CO,驗證符合轉化關系;
(2)A是淡黃色化合物,常見淡黃色固體化合物是過氧化鈉和溴化銀,常溫下D是無色氣體,A能和D反應,所以A是過氧化鈉,D是二氧化碳,過氧化鈉和二氧化碳反應生成碳酸鈉和氧氣,B和E反應生成C,C中含有的陰、陽離子均為10電子粒子,C能和二氧化碳反應生成B,所以B是碳酸鈉,C是氫氧化鈉,E是強堿(如氫氧化鈣、氫氧化鋇),驗證符合轉化關系;
(3)將(2)中一定量的氣體D為二氧化碳,通入2L C的溶液中,C是氫氧化鈉,根據圖象可知,氯化氫的物質的量在前3mol時沒有氣體,后面再加2mol時產生的氣體,根據Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3轉化為NaHCO3、NaHCO3轉化為NaCl需要的HCl的物質的量相等,實際上Na2CO3需要的HCl大于NaHCO3,所以溶液中還存在NaOH,所以二氧化碳通入氫氧化鈉溶液得到的溶液為氫氧化鈉和碳酸鈉的混合物,氯化氫的物質的量在前3mol時發生的反應為Na2CO3+HCl=NaHCO3+NaCl、NaOH+HCl=H2O+NaCl,在后2mol時發生的反應為NaHCO3+HCl=NaCl+H2O+CO2↑,據此進行計算.
解答 解:(1)A是能使濕的紅色石蕊試紙變藍的氣體,為NH3;C、D均為空氣的主要成分,為N2、O2,由轉化關系A$\stackrel{D}{→}$B,故D為O2,B為NO,C為N2,E是一種有毒氣體,結合轉化關系NO$\stackrel{E}{→}$N2,E具有還原性,為CO,驗證符合轉化關系;
①C為N2,電子式為 ,
,
故答案為: ;
;
②故加熱、催化劑條件下,氨氣和氧氣反應生成一氧化氮和水,反應方程式為:4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O;
故答案為:4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O;
③催化劑條件下,一氧化氮和一氧化碳反應生成二氧化碳和氮氣,反應方程式為:2NO+2CO$\frac{\underline{\;催化劑\;}}{\;}$N2+2CO2;
故答案為:2NO+2CO$\frac{\underline{\;催化劑\;}}{\;}$N2+2CO2;
(2)A是淡黃色化合物,常見淡黃色固體化合物是過氧化鈉和溴化銀,常溫下D是無色氣體,A能和D反應,所以A是過氧化鈉,D是二氧化碳,過氧化鈉和二氧化碳反應生成碳酸鈉和氧氣,B和E反應生成C,C中含有的陰、陽離子均為10電子粒子,C能和二氧化碳反應生成B,所以B是碳酸鈉,C是氫氧化鈉,E是強堿(如氫氧化鈣、氫氧化鋇),驗證符合轉化關系.
①C是氫氧化鈉,C中所含化學鍵的類型是離子鍵和共價鍵,
故答案為:離子鍵和共價鍵;
②過氧化鈉和二氧化碳反應生成碳酸鈉和氧氣,反應方程式為:2Na2O2+2CO2=2Na2CO3+O2;
故答案為:2Na2O2+2CO2=2Na2CO3+O2;
(3)將(2)中一定量的氣體D為二氧化碳,通入2L C的溶液中,C是氫氧化鈉,根據圖象可知,氯化氫的物質的量在前3mol時沒有氣體,后面再加2mol時產生的氣體,根據Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3轉化為NaHCO3、NaHCO3轉化為NaCl需要的HCl的物質的量相等,實際上Na2CO3需要的HCl大于NaHCO3,所以溶液中還存在NaOH,所以二氧化碳通入氫氧化鈉溶液得到的溶液為氫氧化鈉和碳酸鈉的混合物,氯化氫的物質的量在前3mol時發生的反應為Na2CO3+HCl=NaHCO3+NaCl、NaOH+HCl=H2O+NaCl,在后2mol時發生的反應為NaHCO3+HCl=NaCl+H2O+CO2↑,
①根據上面的分析可知,O點溶液中所含溶質的化學式為 NaOH、Na2CO3,
故答案為:NaOH、Na2CO3;
②根據上面的分析可知,a點時溶液中的溶質是NaHCO3和NaCl,氯化鈉為強堿強酸鹽,鈉離子和氯離子不水解,NaHCO3為強堿弱酸酸式鹽,其溶液呈堿性,則c(OH-)>c(H+),碳酸氫根離子水解程度大于電離程度,碳酸氫根離子電離生成碳酸根離子,水和碳酸氫根離子都電離生成氫離子,所以c(H+)>c(CO32-),根據元素守恒知c(Na+)>c(Cl-),根據圖象知,NaOH需要HCl和碳酸鈉需要HCl的物質的量之比為1:2,根據原子守恒知,生成氯化鈉的物質的量和碳酸氫鈉的物質的量之比為3:2,根據元素守恒知,溶液中離子濃度大小順序是c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),當氯化氫的物質的量為5mol時,溶液中的溶質為氯化鈉,根元素守恒可知,原溶液中的氫氧化鈉的物質的量為5mol,所以氫氧化鈉溶液的物質的量溶液為$\frac{5mol}{2L}$=2.5mol/l,
故答案為:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);2.5.
點評 本題以元素化合物的推斷為載體考查了元素化合物的性質,同時考查學生分析問題、解決問題的能力,明確物質的性質是解本題的關鍵,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | NaCl、Cl2 | B. | NaHCO3、蔗糖 | C. | Ba(OH)2、HCl | D. | H2SO4、鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 粗硅$→_{高溫}^{氯氣}$ SiCl4 $→_{高溫}^{氫氣}$Si | |
| B. | Mg(OH)2 $\stackrel{鹽酸}{→}$ MgCl2(aq)$\stackrel{電解}{→}$ Mg | |
| C. | Fe2O3 $\stackrel{鹽酸}{→}$ FeCl3(aq)$\stackrel{蒸發}{→}$ 無水FeCl3 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{加熱}^{蔗糖}$ Ag |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{1}{3}$mol | B. | $\frac{4}{3}$mol | C. | 1mol | D. | 2mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 800mL0.5mol/L的NaCl溶液 | B. | 100mL0.3mol/L的AlCl3溶液 | ||
| C. | 500mL0.3mol/L的CaCl2溶液 | D. | 300mL0.3mol/L的MgCl2溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
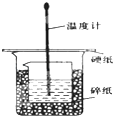 某實驗小組設計用50mL 1.0mol/L鹽酸跟50mL 1.1mol/L 氫氧化鈉溶液在如 圖裝置中進行中和反應.在大燒杯底部墊碎泡沫塑料(或紙條),使放入的小燒杯杯口與大燒杯杯口相平.然后再在大、小燒杯之間填滿碎泡沫塑料(或紙條),大燒杯上用泡沫塑料板(或硬紙板)作蓋板,在板中間開兩個小孔,正好使溫度計和環形玻璃攪拌棒通過.通過測定反應過程中所放出的熱量可計算中和熱.試回答下列問題:
某實驗小組設計用50mL 1.0mol/L鹽酸跟50mL 1.1mol/L 氫氧化鈉溶液在如 圖裝置中進行中和反應.在大燒杯底部墊碎泡沫塑料(或紙條),使放入的小燒杯杯口與大燒杯杯口相平.然后再在大、小燒杯之間填滿碎泡沫塑料(或紙條),大燒杯上用泡沫塑料板(或硬紙板)作蓋板,在板中間開兩個小孔,正好使溫度計和環形玻璃攪拌棒通過.通過測定反應過程中所放出的熱量可計算中和熱.試回答下列問題:| 實驗序號 | 起始溫度t1/℃ | 終止溫度(t2)/℃ | 溫差 (t2-t1)/℃ | ||
| 鹽酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CuSO4 •5H2O、磁性氧化物都是純凈物 | |
| B. | 一種物質不是電解質就是非電解質 | |
| C. | 稀硫酸、NaCl溶液是實驗室常見的電解質 | |
| D. | 二氧化硫可廣泛用于食品的增白 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com