
【題目】某高中化學興趣小組設計合成高分子材料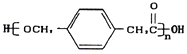
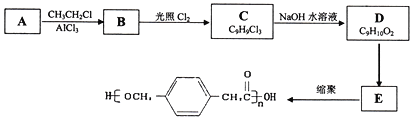
已知:
①A的相對分子質量為92;
②根據結構分析得知同一碳原子上連接兩個羥基時結構不穩定,易脫水生成醛或酮;
③D可與新制的氫氧化銅反應;
回答下列問題:
(1)A的結構簡式為:___________,B的名稱為___________,由B生成C的反應類型是:___________。
(2) 由C生成D的化學方程式為:____________________________,反應過程中生成不穩定的中間產物結構簡式為:___________。
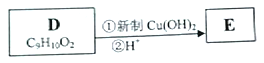
(3)寫出D轉化為E的流程示意圖:___________ (示例![]() )
)
(4)E合成高分子材料的化學反應方程式:_________________________________。
(5)E的同分異構體中,滿足下列條件的有___________種。
①僅含有苯環,無其他環狀結構;
②苯環上只有兩個取代基;
③能使三氯化鐵溶液顯紫色;
④ 含有![]() 的結構;
的結構;
其中核磁共振氫譜表明分子中有六種氫,能發生銀鏡反應且其峰面積之比為2∶2∶2∶2∶1∶1
請寫出其結構簡式為:________________________。
【答案】 ![]() 對甲基乙基苯 取代反應
對甲基乙基苯 取代反應 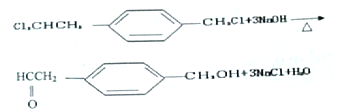
![]()
 +(n-1)H2O 24種
+(n-1)H2O 24種 ![]()
【解析】利用逆向推導法,由高分子材料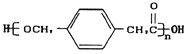 可知發生縮聚反應的單體E為
可知發生縮聚反應的單體E為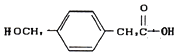 ,根據D的分子式及已知③D可與新制的氫氧化銅反應,則D為
,根據D的分子式及已知③D可與新制的氫氧化銅反應,則D為![]() ,D是由C在氫氧化鈉溶液中發生水解反應而得,結合結構可知,C應該為
,D是由C在氫氧化鈉溶液中發生水解反應而得,結合結構可知,C應該為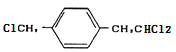 ,B為
,B為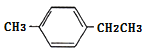 ,A為
,A為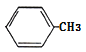 。(1)A的結構簡式為:
。(1)A的結構簡式為: ,B為
,B為 ,名稱為對甲基乙基苯,由B生成C是
,名稱為對甲基乙基苯,由B生成C是 在光照條件下與氯氣發生取代反應生成
在光照條件下與氯氣發生取代反應生成 ;反應類型是取代反應;(2)由C生成D是
;反應類型是取代反應;(2)由C生成D是 在氫氧化鈉的水溶液中加熱反應生成的產物同一碳原子上連接兩個羥基時結構不穩定,易脫水生成醛,則得
在氫氧化鈉的水溶液中加熱反應生成的產物同一碳原子上連接兩個羥基時結構不穩定,易脫水生成醛,則得![]() ,反應的化學方程式為:
,反應的化學方程式為: +3NaOH
+3NaOH![]()
![]() +3NaCl+H2O,反應過程中生成不穩定的中間產物結構簡式為:
+3NaCl+H2O,反應過程中生成不穩定的中間產物結構簡式為:![]() ;(3)D在新制的氫氧化銅懸濁液中加熱,再酸化,轉化為E,流程示意圖為:
;(3)D在新制的氫氧化銅懸濁液中加熱,再酸化,轉化為E,流程示意圖為: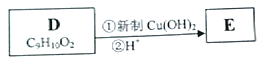 ;(4)E發生縮聚反應,合成高分子材料的化學反應方程式為:
;(4)E發生縮聚反應,合成高分子材料的化學反應方程式為: +(n-1)H2O ;(5)E(
+(n-1)H2O ;(5)E(![]() 的結構,則為羧基或酯基;則苯環上兩個取代基分別為酚羥基,另一個可能為-CH2CH2COOH、-CH(CH3)COOH、-CH2COOCH3、-COOCH2CH3、-OOCCH2CH3、-CH2OOCCH3、-CH2CH2OOCH、- CH(CH3)OOCH,且取代基在苯環上的位置有鄰、間、對位,故同分異構體共3×8=24種;其中核磁共振氫譜表明分子中有六種氫,能發生銀鏡反應則含有甲酸酯的結構,且其峰面積之比為2∶2∶2∶2∶1∶1,取代基在對位,符合的結構簡式為:
的結構,則為羧基或酯基;則苯環上兩個取代基分別為酚羥基,另一個可能為-CH2CH2COOH、-CH(CH3)COOH、-CH2COOCH3、-COOCH2CH3、-OOCCH2CH3、-CH2OOCCH3、-CH2CH2OOCH、- CH(CH3)OOCH,且取代基在苯環上的位置有鄰、間、對位,故同分異構體共3×8=24種;其中核磁共振氫譜表明分子中有六種氫,能發生銀鏡反應則含有甲酸酯的結構,且其峰面積之比為2∶2∶2∶2∶1∶1,取代基在對位,符合的結構簡式為:![]() 。
。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】最近報道的一種處理垃圾滲濾液并用其發電的示意圖如下。裝置工作時,下列說法不正確的是
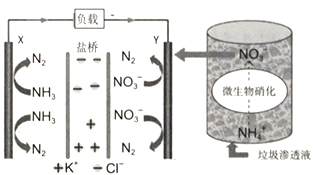
A. 鹽橋中Cl-向Y極移動
B. 化學能轉變為電能
C. 電子由X極沿導線流向Y極
D. Y極發生的反應為2NO3-+10e-+12H+=N2+6H2O,周圍pH增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列反應的化學方程式
(1)工業上制備氯乙烯_____________
(2)2-氯丙烷與KOH 的乙醇溶液共熱____________
(3)實驗室制乙烯__________
(4)中苯在鐵粉催化下與溴單質反應__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)相同質量的![]() 氣體和
氣體和![]() 氣體,其分子數之比為 ______ ,氧原子數之比為 ______ ,相同條件下
氣體,其分子數之比為 ______ ,氧原子數之比為 ______ ,相同條件下![]() 同溫同壓
同溫同壓![]() 的體積之比為 ______ ,密度之比為 ______ .
的體積之比為 ______ ,密度之比為 ______ .
(2)![]() 與
與![]() 的混合氣體中,氧元素的質量分數為
的混合氣體中,氧元素的質量分數為![]() ,則
,則![]() 與
與![]() 的物質的量之比是 ______ ,這種混合氣體的密度是同溫同壓下氧氣密度的 ______ 倍
的物質的量之比是 ______ ,這種混合氣體的密度是同溫同壓下氧氣密度的 ______ 倍![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中,不能用勒夏特列原理解釋的是( )
A. 紅棕色的NO2,加壓后顏色先變深后變淺
B. 高壓比常壓有利于合成SO3的反應
C. Fe(SCN)3溶液中加入固體KSCN后顏色變深
D. 由H2、I2(g)、HI(g)氣體組成的平衡體系加壓后顏色變深
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機物實際存在且命名正確的是 ( )
A. 3-甲基-2-丁烯 B. 2-甲基-5-乙基-1-已烷
C. 2,2-二甲基丁烷 D. 3,3-二甲基-2-戊烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用“五室電滲析法”處理含硫酸鈉廢水的原理如圖所示,以石墨為電極材料,室與室之間用離子交換膜分開(陽膜和陰膜分別只允許陽離子、陰離子通過),下列說法不正確的是 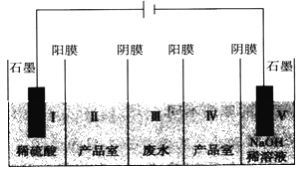
A. 陽極反應式為2H2O-4e-==O2↑+4H+,發生氧化反應
B. 通電片刻后,I、III、V室的pH依次減小、不變、增大
C. 當電路中通過1mol電子時,有1molSO42-從III室進入Ⅱ室
D. 總反應式為Na2SO4+4H2O![]() 2NaOH+H2SO4+O2↑+2H2↑
2NaOH+H2SO4+O2↑+2H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應FeO(s)+C(s)=CO(g)+ Fe(s) 的△H>0,△S >0(假定△H、△S不隨溫度而變化),下列敘述中正確的是( )
A. 低溫下為自發過程,高溫下為非自發過程 B. 高溫下為自發過程,低溫下為非自發過程
C. 任何溫度下均為非自發過程 D. 任何溫度下均為自發過程
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化尿素是一種新型漂白劑、消毒劑、漂白、消毒的效果優于H2O2和過氧乙酸。某工業用過氧化尿素的部分參數見下表:
分子式 | 外觀 | 熱分解溫度 | 熔點 | 水溶性(20℃) |
CO(NH2)2·H2O2 | 白色晶體 | 45℃ | 75~85℃ | 500g·L-1 |
合成過氧化尿素的步驟及反應器的示意圖如下:在250mL三頸燒瓶中加入一定量的30%的H2O2溶液,再加入30g尿素,在不斷攪拌下升溫至300℃,使尿素完全溶解,保溫30min,冷卻至-5℃進行結晶。抽濾得白色粉末狀結晶。在50℃下干燥2h,得過氧化尿素產品。回答下列問題:

(1)控制反應溫度的適宜方法是__________ (填序號)。
A.酒精燈加熱 B.酒精噴燈加熱 C.電爐加熱 D.水浴加熱
(2)反應器中發生反應的化學方程式為___________________________________。
(3)反應器中冷凝管中冷水從______(填“a”或“b”)流進;反應器加熱溫度不能太高的原因是___________。
(4)攪拌器不能選擇鐵質或鋁質材料的原因是_______________________________________。
(5)為測定產品中活性氧的含量(活性氧16%,相當于含H2O234%),稱取干燥樣品12.000g,溶解,在250mL 容量瓶中定容。準確量取25.00mL于錐形瓶中,加入1mL6mol·L-1的硫酸,然后用0.2000mol·L-1KMnO4標準溶液滴定(KMnO4溶液與尿素不反應),平行實驗三次,實驗結果如下:
實驗序號 | 1 | 2 | 3 | |
KMnO4溶液體積/mL | 滴定前讀數 | 0.00 | 0.00 | 2.00 |
滴定后讀數 | 19.98 | 21.70 | 22.02 | |
①KMnO4溶液應盛放在__________滴定管中,滴定終點的現象是_____________。
②產品中活性氧的質量分數為____________。
③若滴定前滴定管尖嘴處無氣泡,滴定后有氣泡,會使測得的活性氧含量__________(填“偏高”“偏低”或“不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com