
【題目】根據反應 8NH3 + 3Cl2 = N2 + 6NH4Cl,回答下列問題:
①用雙線橋法標出該反應中電子轉移的方向和數目:_____.
②該反應中_____元素被還原,_____元素被氧化.
③氧化劑和還原劑的物質的量之比為_____.
④在該反應中,若有 3mol 電子發生轉移,在標準狀況下,可生成N2的體積為_____L.
【答案】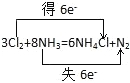 Cl N 3:2 11.2
Cl N 3:2 11.2
【解析】
該反應中N元素化合價由-3價變為0價、Cl元素化合價由0價變為-1價,所以NH3是還原劑、Cl2是氧化劑,再結合氮氣和還原劑之間的關系式計算生成氮氣的體積。
①用雙線橋標出電子轉移的方向和數目可為  ,
,
因此,本題正確答案是: ;
;
②該反應中N元素化合價由-3價變為0價,被氧化,Cl元素化合價由0價變為-1價,被還原,
因此,本題正確答案是:Cl;N;
③由方程式可以知道,當有8mol氨氣參加反應,有2mol被氧化,同時有3mol氯氣參加反應,氧化劑和還原劑的物質的量之比為3:2,
因此,本題正確答案是:3:2;
④N元素化合價由-3價升高0價,在當反應過程中有3mol電子轉移時,有0.5mol氮氣生成,標準狀況下的體積為0.5mol![]() 22.4L/mol=11.2L,
22.4L/mol=11.2L,
因此,本題正確答案是:11.2。


科目:高中化學 來源: 題型:
【題目】某有機物A的結構簡式如圖所示,某同學對其可能具有的化學性質進行了如下預測
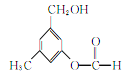
①可以使酸性高錳酸鉀溶液褪色
②可以和NaOH溶液反應
③在一定條件下可以和乙酸發生反應
④在一定條件下可以發生消去反應
⑤在一定條件下可以和新制Cu(OH)2反應
⑥遇FeCl3溶液可以發生顯色反應
其中正確的是( )
A. ①②③⑥ B. ①②③⑤ C. ①②③④ D. ①②④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳的捕捉和利用是我國能源領域的一個重要戰略方向。
(1)工業上用CO2和H2反應合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
寫出CO2(g)和H2(g)轉化為CH3OCH3(g)和H2O(g)的熱化學方程式:________________________________________________________________________。
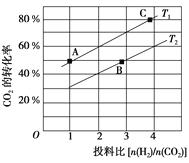
(2)在某壓強下,合成二甲醚的反應在不同溫度、不同投料比時,CO2的平衡轉化率如圖所示。T1溫度下,將6 mol CO2和12 mol H2充入2 L的密閉容器中,5 min后反應達到平衡狀態,則0~5 min內的平均反應速率v(CH3OCH3)=______________________________;KA、KB、KC三者之間的大小關系為______________________________。
(3)若2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒溫恒壓下進行,以下敘述能說明該反應達到平衡狀態的是________(填序號)。
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒溫恒壓下進行,以下敘述能說明該反應達到平衡狀態的是________(填序號)。
A.CO和H2的物質的量濃度之比是1∶2
B.CO的消耗速率等于CH3OCH3的生成速率的2倍
C.容器中混合氣體的體積保持不變
D.容器中混合氣體的平均摩爾質量保持不變
E.容器中混合氣體的密度保持不變
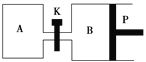
(4)如圖P是可自由平行滑動的活塞,關閉K,在相同溫度時,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),兩容器分別發生反應CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)。已知起始時容器A和B的體積均為a L,反應達到平衡時容器B的體積為1.5a L,容器B中CH3OH轉化率為________;維持其他條件不變,若打開K一段時間后重新達到平衡,容器B的體積為________L(連通管中氣體體積忽略不計,且不考慮溫度的影響)。
CO2(g)+3H2(g)。已知起始時容器A和B的體積均為a L,反應達到平衡時容器B的體積為1.5a L,容器B中CH3OH轉化率為________;維持其他條件不變,若打開K一段時間后重新達到平衡,容器B的體積為________L(連通管中氣體體積忽略不計,且不考慮溫度的影響)。
(5)CO2溶于水形成H2CO3。已知常溫下H2CO3的電離平衡常數為K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的電離平衡常數為K=1.75×10-5。常溫下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液顯________(填“酸性”“中性”或“堿性”);請計算反應NH+HCO+H2O![]() NH3·H2O+H2CO3的平衡常數K=________________________________________________________________________。
NH3·H2O+H2CO3的平衡常數K=________________________________________________________________________。
(6)工業上采用電化學還原CO2是一種使CO2資源化利用的方法,如圖是利用此法制備ZnC2O4的示意圖(電解液不參與反應),下列說法正確的是____________。
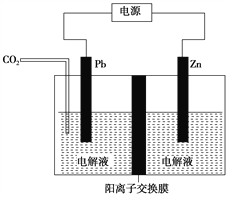
A.Zn與電源的負極相連
B.ZnC2O4在交換膜右側生成
C.電解的總反應式為2CO2+Zn![]() ZnC2O4
ZnC2O4
D.通入11.2 L CO2,轉移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】書寫化學反應方程式是高中僧的必備技能,快來闖關吧!
(1)鈉加入到三氯化鐵溶液中發生的反應(總方程式):_________________________________________________________________
(2)過氧化鈉與水的反應:_________________________________________________________________
(3)過氧化鈉與二氧化碳的反應:_________________________________________________________________
(4)碳酸氫鈉與氫氧化鈉的反應: _________________________________________________________________
(5)碳酸氫鈉受熱分解: _________________________________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷在鎳催化作用下可與水反應制合成氣(CO和H2),再制成甲醇代替燃油。
(1)CH4和H2O所含的三種元素電負性從小到大的順序為________。
(2)CH4和CO2分子中碳原子的雜化類型分別是_____和_______。
(3)基態Ni原子的電子排布式為______,該元素位于元素周期表的第_____族。
(4)金屬鎳粉在CO氣流中輕微加熱,生成無色揮發性液態Ni(CO)4,該分子呈正四面體構型。則1molNi(CO)4中含有____molσ鍵,Ni(CO)4的晶體類型為_____,Ni(CO)4易溶于下列___(填選項字母)中。
a.水 b.四氧化碳 C.苯 d.硫酸鎳溶液
(5)如圖是一種鎳鑭合金儲氫后的晶胞結構示意圖。該合金中原子個數比La:Ni=_____,儲氫后,含1molLa的合金可吸附H2的數目為______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為除去粗鹽中的鈣離子、鎂離子、硫酸根離子及泥沙等雜質,某同學設計了一種制備精鹽的實驗方案,步驟如下(用于沉淀的試劑稍過量):
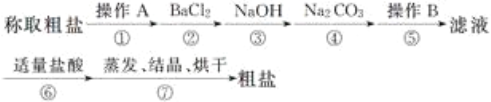
(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,寫出相應的化學方程式(設粗鹽溶液中Ca2+的主要存在形式為氯化鈣)____________________________。
(3)若先用鹽酸調溶液至中性,再過濾,將對實驗結果產生影響,其原因是_________________________。
(4)判斷氯化鋇已過量的方法是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將1molCH4和適量的氧氣在密閉容器中點燃,充分反應后,甲烷和氧氣均無剩余,且產物均為氣體(101kPa,120℃),其總質量為72g,下列有關敘述不正確的是
A. 若將產物通過堿石灰,則可全被吸收,若通過濃硫酸,則不能被完全吸收
B. 產物的平均摩爾質量為24g/mol
C. 若將產物通過濃硫酸充分吸收后恢復至(101kPa,120℃),則壓強變為原來的1/3
D. 反應中消耗的氧氣為56g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋植物如海帶和海藻中含有豐富的碘元素,碘元素以碘離子的形式存在。實驗室里從海洋中提取碘的流程如下:
![]()
某化學興趣小組將上述流程②、③設計成如下圖所示操作。
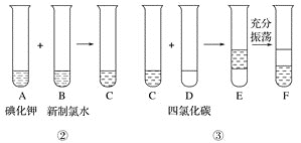
已知過程②發生反應的化學方程式為Cl2+2KI=2KCl+I2
回答下列問題:
(1)寫出提取過程①、③中實驗操作的名稱:①____________,③____________。
(2)在灼燒過程中,使用到的實驗儀器有酒精燈、泥三角、三腳架、玻璃棒、____________、____________。
(3)F中下層液體的顏色為________色,上層液體中溶質的主要成分為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com