
電石是重要的工業原料,電石渣[主要成分Ca(OH)2]的綜合利用體現了綠色化學思想。
(1)用電石為原料可生產聚氯乙烯。聚氯乙烯的結構簡式為____________。
(2)電石渣可用于除去垃圾焚燒爐煙道氣中的SO2生成CaSO4,反應中的氧化劑是____________ (填名稱)。
(3)電石渣可用于生產純堿。涉及的部分化學反應為:
(i)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(ii)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
此生產過程中,可循環利用的物質有____________ (填化學式)。
(4)用電石渣處理酸性含鉻(Cr2O72—)電鍍廢水的流程如下:

①步驟(i)發生反應的化學方程式為__________________
②步驟(ii)發生反應的離子方程式為__________________
③步驟(iii)調節溶液pH為8,則殘留Cr3+的濃度為______(Ksp[Cr(OH)3]=6.3×10—31)。
(15分)(1)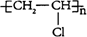 (2分)
(2分)
(2)氧氣(2分)
(3)NH3、CO2、H2O(各1分,共3分)
(4)①2SO2+Na2CO3+H2O=2NaHSO3+CO2(3分)
②3HSO3—+Cr2O72—+5H+=3SO42—+2Cr3++4H2O(3分)
③6.3×10—13molL(漏寫單位扣1分,共2分)
【解析】
試題分析:(1)略;(2)電石渣的主要成分是氫氧化鈣、碳酸鈣等,SO2被吸收后變為亞硫酸鈣,然后被空氣中的氧氣氧化為硫酸鈣;(3)碳酸鈣熱分解生成CaO、CO2,CaO與水反應生成Ca(OH)2,共四步反應中,NH3、CO2、H2O可以循環利用;(4)①亞硫酸的酸性比碳酸強,則吸氣步驟反應式為2SO2+Na2CO3+H2O=2NaHSO3+CO2;根據電子、電荷、原子守恒可知,還原步驟反應式為3HSO3—+Cr2O72—+5H+=3SO42—+2Cr3++4H2O;常溫下pH=8,則c(OH—)=Kw/c(H+)=10—6mol/L,Cr(OH)3(s) Cr3+(aq)+3OH—(aq),Ksp[Cr(OH)3]=c(Cr3+)•c3(OH—)=6.3×10—31,則c(Cr3+)=6.3×10—13mol/L。
Cr3+(aq)+3OH—(aq),Ksp[Cr(OH)3]=c(Cr3+)•c3(OH—)=6.3×10—31,則c(Cr3+)=6.3×10—13mol/L。
考點:考查結構簡式的書寫、氧化劑、綠色化學理念、化學方程式、離子方程式、溶度積的計算等相關知識。


 暑假銜接培優教材浙江工商大學出版社系列答案
暑假銜接培優教材浙江工商大學出版社系列答案 欣語文化快樂暑假沈陽出版社系列答案
欣語文化快樂暑假沈陽出版社系列答案科目:高中化學 來源: 題型:


| ||

查看答案和解析>>
科目:高中化學 來源:2011-2012年云南省高二上學期期中聯考化學試卷(理科) 題型:填空題
(12分)為探究乙炔與溴的加成反應,甲同學設計并進行了如下實驗:先取一定量工業用電石與水反應,將生成的氣體通入溴水中,發現溶液褪色,即證明乙炔與溴水發生了加成反應。
乙同學發現在甲同學的實驗中,褪色后的溶液里有少許淡黃色渾濁,推測在制得的乙炔中還可能含有少量還原性的雜質氣體,由此他提出必須先除去之,再與溴水反應。請你回答下列問題:
(1)寫出甲同學實驗中兩個主要的化學方程式1
2 。
(2)為了減緩電石與水的反應速率,實驗時常用 代替水。
(3)乙同學推測此乙炔中含有雜質氣體H2S,實驗時,常用硫酸銅溶液除去該雜質氣體,寫出相應的化學方程式 。
(4)乙炔是重要的化工材料,常見的塑料聚氯乙烯(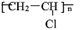 )就是以乙炔為原材料制得的。寫出以乙炔和HCl為原料制聚氯乙烯的化學方程式。
)就是以乙炔為原材料制得的。寫出以乙炔和HCl為原料制聚氯乙烯的化學方程式。
(1) ,(2)
查看答案和解析>>
科目:高中化學 來源: 題型:
(12分)為探究乙炔與溴的加成反應,甲同學設計并進行了如下實驗:先取一定量工業用電石與水反應,將生成的氣體通入溴水中,發現溶液褪色,即證明乙炔與溴水發生了加成反應。
乙同學發現在甲同學的實驗中,褪色后的溶液里有少許淡黃色渾濁,推測在制得的乙炔中還可能含有少量還原性的雜質氣體,由此他提出必須先除去之,再與溴水反應。請你回答下列問題:
(1)寫出甲同學實驗中兩個主要的化學方程式1
2 。
(2)為了減緩電石與水的反應速率,實驗時常用 代替水。
(3)乙同學推測此乙炔中含有雜質氣體H2S,實驗時,常用硫酸銅溶液除去該雜質氣體,寫出相應的化學方程式 。
(4)乙炔是重要的化工材料,常見的塑料聚氯乙烯()就是以乙炔為原材料制得的。寫出以乙炔和HCl為原料制聚氯乙烯的化學方程式。
(1) ,(2)
查看答案和解析>>
科目:高中化學 來源:2011-2012年云南省昆明三中、滇池中學高二上學期期中聯考化學試卷(理科) 題型:填空題
(12分)為探究乙炔與溴的加成反應,甲同學設計并進行了如下實驗:先取一定量工業用電石與水反應,將生成的氣體通入溴水中,發現溶液褪色,即證明乙炔與溴水發生了加成反應。
乙同學發現在甲同學的實驗中,褪色后的溶液里有少許淡黃色渾濁,推測在制得的乙炔中還可能含有少量還原性的雜質氣體,由此他提出必須先除去之,再與溴水反應。請你回答下列問題:
(1)寫出甲同學實驗中兩個主要的化學方程式1
2 。
(2)為了減緩電石與水的反應速率,實驗時常用 代替水。
(3)乙同學推測此乙炔中含有雜質氣體H2S,實驗時,常用硫酸銅溶液除去該雜質氣體,寫出相應的化學方程式  。
。
(4)乙炔是重要的化工材料,常見的塑料聚氯乙烯(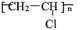 )就是以乙炔為原材料制得的。寫出以乙炔和HCl為原料制聚氯乙烯的化學方程式。
)就是以乙炔為原材料制得的。寫出以乙炔和HCl為原料制聚氯乙烯的化學方程式。
(1) ,(2)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com