
【題目】已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,下列說法正確的是
A.H2(g)的燃燒熱為571.6 kJ·mol-1
B.同質量的H2(g)和CH3OH(l)完全燃燒,H2(g)放出的熱量多
C.![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
【答案】B
【解析】
A. 燃燒熱是指1mol純物質完全燃燒生成穩定的氧化物所放出的熱量,所以H2的燃燒熱為1/2×571.6kJ/mol,故A錯誤;
B. 令H2(g)和CH3OH(l)的質量都為1g,則1g氫氣燃燒放熱為1/2×1/2×571.6=142.45kJ,1gCH3OH燃燒放熱為1/32×1/2×1452=22.68kJ,所以H2(g)放出的熱量多,故B正確;
C. 中和熱是強酸強堿的稀溶液完全反應生成1mol水時放出的熱量,故C錯誤;
D.2H2(g)+O2(g)═2H2O(l)△H=571.6kJmol-1改寫為3H2(g)+3/2O2(g) ═ 3H2O(l) △H=(3/2×571.6)kJmol1,2CH3OH(l)+3O2(g) ═ 2CO2(g)+4H2O(l) △H=1452kJmol1改寫為CO2(g)+2H2O(l) = CH3OH(l)+3/2O2(g)) △H=+(1/2×1452)kJmol1改寫后的方程相加即得3H2(g)+CO2(g) = CH3OH(l)+H2O(l),所以其△H═(3/2×571.6)+(1/2×1452)=131.4kJmol1,故D錯誤;
故選B。


科目:高中化學 來源: 題型:
【題目】一定條件下向某密閉容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三種氣體,圖 1 表示各物質濃度隨時間的變化,圖 2 表示速率隨時間的變化,t2、t3、t4、t5 時刻各改變一種條件,且改變的條件均不同。若t4時刻 改變的條件是壓強,則下列說法錯誤的是

A.若 t1=15 s,則前 15 s 的平均反應速率 v(C)=0.004 mol·L-1·s-1
B.該反應的化學方程式為 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 時刻改變的條件分別是升高溫度、加入催化劑、增大反應物濃度
D.若 t1=15 s,則 B 的起始物質的量為 0.04 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下面的信息,下列敘述正確的是( )

A. 2 mol H2(g)跟 1 mol O2(g)反應生成 2 mol H2O(g)吸收能量為490 kJ
B. 化學反應中能量變化的大小與反應物的質量多少無關
C. 1 mol H2(g) 跟0.5mol O2(g) 反應生成 1 mol H2O(l)釋放能量為245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)與1 mol O2(g)的能量之和低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化尿素(CO(NH2)2·H2O2)是過氧化氫水溶液與尿素的加和物,兼有尿素和過氧化氫的性質,是一種新型漂白、消毒劑,廣泛應用于農業、醫藥、日用化工等領域。某化學小組同學用低濃度的雙氧水和飽和尿素[CO(NH2)2]溶液在30℃條件下用右圖裝置合成過氧化尿素。請回答下列問題:
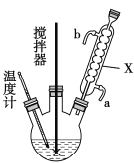
(1)儀器X的名稱是______________;
(2)制備過氧化尿素的化學方程式為_______________________,反應時采取的受熱方式為_____________;
(3)攪拌器不能選擇鐵質材料的原因是______________________
(4)過氧化尿素中活性氧含量的高低直接決定產品的質量,合格產品中活性氧的含量≥16%(相當于其中含H2O234%)。為了確定所得產品合格與否,質檢員稱取干燥樣品8.000g,溶解于水,在250mL容量瓶中定容,準確量取其中25.00mL溶液于錐形瓶中,加入1mL6mol·L-1H2SO4,然后用0.2000mol·L-1KMnO4標準溶液滴定樣品中的H2O2(KMnO4溶液與尿素不反應)。三次滴定平均消耗KMnO4溶液20.000mL:
①請完善滴定時反應的離子方程式:__MnO![]() +___H2O2+______==_______________
+___H2O2+______==_______________
②若滴定前滴定管尖嘴處有氣泡,滴定后消失,會使測得的活性氧含量_______(填“偏高”、“偏低”或“不變”);
③根據滴定結果確定產品質量_______(填“合格”或“不合格”),活性氧的質量分數為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】M、R均為主族元素,已知M的一個原子失去2個電子,R的一個原子得到1個電子后形成稀有氣體元素的電子層結構。下列關于M與R形成的化合物的敘述正確的是( )
A. M與R可以形成MR2型離子化合物
B. 在MR2中M的離子半徑比R的離子半徑大
C. 形成的兩種離子分別是M+和R2-
D. MR2的電子式為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 同溫同壓下,H2 (g)+Cl2(g)![]() 2HCl(g)在光照和點燃條件下的ΔH相同
2HCl(g)在光照和點燃條件下的ΔH相同
B. 任何酸與堿發生中和反應生成1 mol H2O的過程中,能量變化均相同
C. 已知:①2H2(g) +O2(g)![]() 2H2O(g)ΔH=-a kJ·mol-1,②2H2(g)+O2 (g)
2H2O(g)ΔH=-a kJ·mol-1,②2H2(g)+O2 (g)![]() 2H2O(l)ΔH=-b kJ·mol-1,則a>b
2H2O(l)ΔH=-b kJ·mol-1,則a>b
D. 已知:①C(s,石墨)+O2 (g)![]() CO2(g)ΔH=-393.5 kJ·mol-1,②C(s,金剛石)+O2(g)
CO2(g)ΔH=-393.5 kJ·mol-1,②C(s,金剛石)+O2(g)![]() CO2 (g)ΔH=-395.0 kJ·mol-1,則C(s,石墨)
CO2 (g)ΔH=-395.0 kJ·mol-1,則C(s,石墨)![]() C(s,金剛石)ΔH= -1.5 kJ·mol-1
C(s,金剛石)ΔH= -1.5 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前我國研制的稀土催化劑催化轉化汽車尾氣示意圖如下:
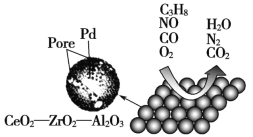
(1)Zr原子序數為40,價電子排布式為4d25s2,它在周期表中的位置是_______________。
(2)圖中互為等電子體的兩種氣體分子是_____________。
(3)C3H8中所有碳原子的雜化方式是___________。
(4)圖中屬于非極性的氣體分子是_______________________。
Fe、Mn元素的部分電離能數據列于下表中
元素 | Fe | Mn | |
電離能(kJ·mol-1) | I1 | 759 | 717 |
I2 | 1561 | 1509 | |
I3 | 2957 | 3248 | |
(5)從上表兩元素部分電離能數據比較的可知,氣態Mn2+再失去一下電子比氣態Fe2+再夫去一個電子難,原因是_____________。
(6)CO與Ni可生成羰基鎳[Ni(CO)4],已知其中鎳的化合價為0,鎳原子在基態時核外電子排式為_____________,[Ni(CO)4]的配體是_________,配位原子是__________。
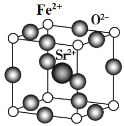
(7)為了節省貴金屬并降低成本,也常用鈣鈦礦型復合氧化物作為催化劑。一種復合氧化物結構如圖所示,則與每個Sr2+緊鄰的O2-有______個。
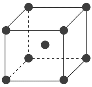
(8)與Zr相鄰的41號元素Nb金屬的晶格類型為體心立方晶格,原子半徑為apm,相對原子質量為b,阿伏加德羅常數為NA,試計算晶體鈮的密度為______________g·cm-3(用來a、b、NA表示計算結果)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中山大學化學科研團隊首次將CsPbBr3納米晶錨定在氨基化RGO包覆的α—Fe2O3(α—Fe2O3/Amine—RGO/CsPbBr3),構筑Z—Scheme異質結光催化劑,可有效降低電荷復合,促進電荷分離,從而提升光催化性能。光催化還原CO2和氧化H2O的反應路徑如圖。下列說法正確的是( )
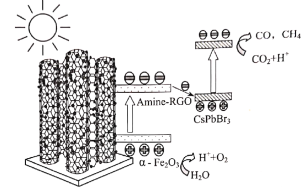
A.該路徑能量轉化形式為電能→化學能
B.該光催化轉化反應可以阻止溫室效應
C.“CsPbBr3納米晶”表面發生了還原反應
D.該催化轉化的總反應涉及到非極性共價鍵、極性共價鍵的斷裂和形成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丹參素(I)是一種具有改善心臟功能、抗血栓形成、促進組織的修復與再生等多種作用的藥物。該藥物的一種合成路線如下:
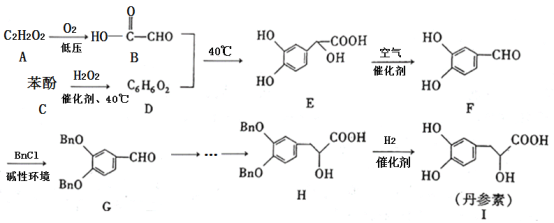
已知:![]() 代表芐基(
代表芐基(![]() )
)
請回答下列問題:
(1)![]() 的結構簡式為_______,
的結構簡式為_______,![]() 中所含官能團的名稱為羥基、______。
中所含官能團的名稱為羥基、______。
(2)![]() 的反應類型為_______,該反應的目的是________。
的反應類型為_______,該反應的目的是________。
(3)寫出![]() 的化學方程式:________。
的化學方程式:________。
(4)苯酚與![]() 反應可以制備物質
反應可以制備物質![]() (
(![]() )。
)。![]() 是
是![]() 的同系物,相對分子質量比
的同系物,相對分子質量比![]() 大14。則符合下列條件的
大14。則符合下列條件的![]() 的同分異構體有______種(不考慮立體異構)。
的同分異構體有______種(不考慮立體異構)。
①苯環上只有兩個取代基 ②能與![]() 溶液發生顯色反應 ③能發生銀鏡反應 ④紅外光譜表明分子中不含醚鍵
溶液發生顯色反應 ③能發生銀鏡反應 ④紅外光譜表明分子中不含醚鍵
其中核磁共振氫譜有6組峰,且峰面積之比為![]() 的結構簡式為________(寫出一種即可)。
的結構簡式為________(寫出一種即可)。
(5)參照丹參素的上述合成路線,以![]() 為原料,設計制備
為原料,設計制備![]() 的合成路線:____________。
的合成路線:____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com