
食鹽是日常生活的必需品,也是重要的化工原料。
(1)粗食鹽常含有少量Ca2+、Mg2+、SO42-等雜質離子,實驗室提純NaCl的流程如下:
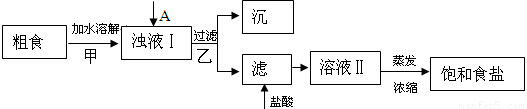
提供的試劑:飽和Na2CO3溶液 飽和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
(1)①欲除去濁液Ⅰ中的Ca2+、Mg2+、SO42-,選出A所代表的試劑,按滴加順序依次為 (只填化學式),檢驗溶液中SO42-沉淀完全的操作為 。
②加鹽酸的目的是(用離子方程式表示) 。
③上述流程中,甲、乙兩個過程均要用到玻璃棒,玻璃棒的作用分別是甲 ,乙 。
(2)工業(yè)上用惰性電極電解飽和食鹽水法制取鹽酸,寫出電解飽和食鹽水的化學方程式 ;用試紙檢驗電解食鹽水陽極產物的方法是 。
(1)①BaCl2、NaOH 、Na2CO3或NaOH、BaCl2、Na2CO3
稍待片刻,待沉淀沉降完畢,上層出現清液,向上層清液中繼續(xù)滴加氯化鋇溶液,無沉淀生成,則沉淀完全。
②OH-+H+=H2O CO32-+2H+=H2O+CO2↑
③攪拌引流
(2)2NaCl+2H2O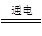 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
用濕潤的藍色石蕊試紙放在陽極區(qū)氣體中,試紙先變紅,后退色,證明有氯氣生成(或用濕潤的KI-淀粉試紙放在陽極區(qū)氣體中,試紙變藍色)
【解析】
試題分析:(1)沉淀Ca2+用Na2CO3溶液、沉淀Mg2+用NaOH溶液、沉淀SO42-用BaCl2溶液,但要注意除雜試劑必須過量且過量的試劑后續(xù)過程中需除去,所以試劑滴加的順序是BaCl2、NaOH 、Na2CO3或NaOH、 BaCl2、Na2CO3。檢驗SO42-沉淀完全的操作方法為將濁液靜置,向上層清液中繼續(xù)滴加氯化鋇溶液,無沉淀生成,說明SO42-完全沉淀;濾液中加鹽酸的作用是除去過量的CO32-和OH-;溶解時用玻璃棒攪拌,加快溶解速度。過濾時用玻璃棒引流。
(2)電解飽和食鹽水生成氫氧化鈉、氫氣和氯氣;陽極產生氯氣,可用濕潤淀粉-KI試紙檢驗。
考點:化學實驗 電解 元素及其化合物
點評:除雜時要注意試劑加入的順序且所加試劑需過量,過量的試劑后續(xù)過程中需除去。


科目:高中化學 來源: 題型:
(1)炸油條時1 kg面粉需加入0.5 kg水,4 g明礬和10 g小蘇打及少量食鹽等輔料,經烹炸,成品油條的產率一般為80%,通過計算說明若每天食用100 g油條,則攝入鋁的量是__________________。?
(2)請列舉我國國民在日常生活中攝入鋁(除食品添加劑外)的三種可能途徑。______________________________________________________________________?
查看答案和解析>>
科目:高中化學 來源:0115 月考題 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com