
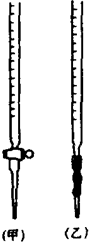
 某化學興趣小組為了測定草酸濃度及硫酸酸化的高錳酸鉀溶液與草酸(H2C2O4)溶液反應的化學反應速率大小并驗證離子反應的本質,設計了如下實驗.化學反應如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 實驗主要步驟如下:Ⅰ.用0.1000mol?L-1酸性高錳酸鉀溶液滴定未知濃度的H2C2O4溶液Ⅱ.測定化學反應速率.Ⅲ.驗證紫紅色是MnO4-離子.請回答:
某化學興趣小組為了測定草酸濃度及硫酸酸化的高錳酸鉀溶液與草酸(H2C2O4)溶液反應的化學反應速率大小并驗證離子反應的本質,設計了如下實驗.化學反應如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 實驗主要步驟如下:Ⅰ.用0.1000mol?L-1酸性高錳酸鉀溶液滴定未知濃度的H2C2O4溶液Ⅱ.測定化學反應速率.Ⅲ.驗證紫紅色是MnO4-離子.請回答:| 滴定次數 | H2C2O4體積 | 滴定前KMnO4體積 | 終點時KMnO4體積 |
| 1 | 25.00mL | 0.00mL | 21.40mL |
| 2 | 25.00mL | 0.02mL | 21.44mL |
| 3 | 25.00mL | 0.04mL | 22.46mL |
| 2 |
| 5 |
| 5 |
| 2 |
| V(KMnO4)?c(KMnO4) |
| V(H2C2O4) |
| △c |
| △t |
| 2 |
| 5 |
| 5 |
| 2 |
| V(KMnO4)?c(KMnO4) |
| V(H2C2O4) |
| 0.1mol/L×2mL |
| 2mL+2mL |
| 0.05mol/L |
| 10s |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
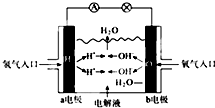
| A、a電極是負極 |
| B、b電極的電極反應為O2+4e-+2H2O=4OH- |
| C、工作時,溶液中陰離子向正極移動,陽離子向負極移動 |
| D、此電池能將化學能轉化為電能 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 編號 | 往燒杯中加入的試劑及其用量(mL) | 催化劑 | 溶液開始變藍時間(min) | ||||
| 0.1 mol?L-1 KI溶液 | H2O | 0.01mol?L-1 X 溶液 | 0.1 mol?L-1 雙氧水 | 1 mol?L-1 稀鹽酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 無 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 無 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 無 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 如圖所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同溫度和有催化劑的條件下,兩容器中各自發生下列反應X(g)+Y(g)?2N(g)+W(g),△H>0達到平衡時,v(A)=1.2aL,則下列說法錯誤的是( )
如圖所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同溫度和有催化劑的條件下,兩容器中各自發生下列反應X(g)+Y(g)?2N(g)+W(g),△H>0達到平衡時,v(A)=1.2aL,則下列說法錯誤的是( )| A、反應開始時,B容器中化學反應速率快 |
| B、A容器中X的轉化率為40%,且比B中X的轉化率小 |
| C、打開K一段時間,達到新平衡時,A的體積為2.6aL(兩邊通管中氣體體積不計) |
| D、打開K達新平衡后,升高B容器溫度,A容器體積會增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com