
(13分)以硫鐵礦(主要成分為FeS2)為原料制備氯化鐵晶體(FeCl3·6H2O)的工藝流程如下:
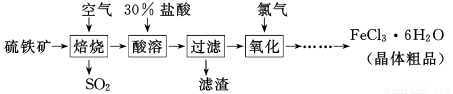
回答下列問題:
Ⅰ、(1)在一定條件下,SO2轉化為SO3的化學反應為2SO2(g)+O2(g)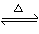 2SO3(g),該反應的平衡常數表達式為K= ;過量的SO2與NaOH溶液反應的化學方程式為 。
2SO3(g),該反應的平衡常數表達式為K= ;過量的SO2與NaOH溶液反應的化學方程式為 。
(2)酸溶及后續過程中均需保持鹽酸過量,其目的是 、 。
(3)通氯氣氧化時,發生的主要反應的離子方程式為 ;該過程產生的尾氣可用堿溶液吸收,尾氣中污染空氣的氣體為 (寫化學式)。
Ⅱ、 已知: CuCl2溶液中含有少量雜質FeCl2,為制備純凈的CuCl2·2H2O晶體,擬定實驗步驟如圖所示:
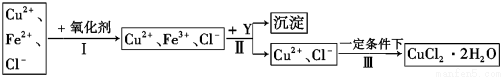
請回答下列問題:
(4)步驟Ⅰ中,將Fe2+轉化為Fe3+最好選用下列氧化劑中的 (填字母)。
A.K2Cr2O7 B.NaClO C.H2O2
該反應的離子方程式為 。
(5)在步驟Ⅱ中,加入Y的目的是為了調節溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物質中的 (填字母)。
A.NaOH B.Cu C.Cu2(OH)2CO3
(6)步驟Ⅲ應控制的實驗條件是 。
(13分)
(1)c(SO3)2/c(O2)·c(SO2)2 (1分) SO2+NaOH=NaHSO3(1分)
(2)提高鐵元素的浸出率(1分) 抑制Fe3+水解(1分)
(3)Cl2+2Fe2+===2Cl-+2Fe3+(1分) Cl2、HCl(2分)
(4)C(1分) 2Fe2++H2O2+2H+===2Fe3++2H2O (2分)
(5)C(1分)
(6)將溶液在較低溫度下加熱蒸發析出晶體,同時通入氯化氫氣體防止水解(2分)
【解析】
試題分析:(1)根據平衡常數額表達式得該反應的平衡常數K= c(SO3)2/c(O2)·c(SO2) 2;過量的SO2與NaOH溶液反應生成亞硫酸氫鈉,化學方程式為SO2+NaOH=NaHSO3;
(2)保持鹽酸過量的目的是提高鐵元素的浸出率,同時由于鐵離子水解生成氫氧化鐵和氯化氫,所以加入過量的鹽酸還可以防止鐵離子的水解;
(3)氯氣與亞鐵離子反應生成鐵離子,離子方程式為Cl2+2Fe2+===2Cl-+2Fe3+;該過程產生的尾氣主要是Cl2、HCl,可用氫氧化鈉溶液吸收;
(4)步驟Ⅰ中,將Fe2+轉化為Fe3+最好選用下列氧化劑中過氧化氫,因為A、B氧化劑雖然可以氧化亞鐵離子,但同時會引入其他雜質,而過氧化氫做氧化劑,還原產物是水,所以答案選C;過氧化氫與亞鐵離子反應的離子方程式為2Fe2++H2O2+2H+===2Fe3++2H2O ;
(5)A、氫氧化鈉和鐵離子生成氫氧化鐵沉淀,同時銅離子也會沉淀,溶液中引入鈉離子雜質,錯誤;B、Cu與鐵離子反應不會生成沉淀,錯誤;C、Cu2(OH)2CO3與鹽酸反應生成氯化銅、水、二氧化碳,調節了溶液的pH,同時未引入新的雜質,正確,答案選C;
(6)步驟Ⅲ是把氯化銅溶液轉化為氯化銅晶體,而銅離子易水解,加熱會促進水解的進行,所以實驗條件是將溶液在較低溫度下加熱蒸發析出晶體,同時通入氯化氫氣體防止水解。
考點:考查對工業流程的分析,實驗條件的判斷,離子方程式的書寫


科目:高中化學 來源:2015屆浙江省“溫州八校”高三返校聯考化學試卷(解析版) 題型:選擇題
在1100 ℃,一定容積的密閉容器中發生反應:FeO(s)+CO(g)  Fe(s)+CO2(g) ΔH=a kJ/mol(a>0),該溫度下K=0.263,下列有關該反應的說法正確的是
Fe(s)+CO2(g) ΔH=a kJ/mol(a>0),該溫度下K=0.263,下列有關該反應的說法正確的是
A.若生成1 mol Fe,則吸收的熱量小于a kJ
B.若升高溫度,正反應速率加快,逆反應速率減慢,則化學平衡正向移動
C.若容器內壓強不隨時間變化,則可以判斷該反應已達到化學平衡狀態
D.達到化學平衡狀態時,若c(CO)=0.100 mol/L,則c(CO2)=0.0263 mol/L
查看答案和解析>>
科目:高中化學 來源:2015屆河南省高三上學期第一次測試化學試卷(解析版) 題型:填空題
(14分)(1)用質量分數為36.5%的濃鹽酸(密度為1.16g/cm3)配制成1mol/L的稀鹽酸。現實驗室僅需要這種鹽酸220mL。試回答下列問題:
①配制稀鹽酸時,應選用容量為______mL的容量瓶;
②經計算需要______mL濃鹽酸,在量取時宜選用下列量筒中的______。
A.5ml B.10mL C.25mL D.50mL
(2)若某藥品質量約為32.0 g,用托盤天平準確稱其質量,若用↓表示在右盤放上砝碼,用↑表示將砝碼取下,在下列表格的空格內,用↓和↑表示相應砝碼的放上或取下。
50 g | 20 g | 20 g | 10 g | 5 g |
|
|
|
|
|
(3)在配制一定物質的量濃度的溶液時,用“偏高、偏低、無影響”表示下列操作對所配溶液濃度的影響。
①用量筒取液態溶質,讀數時,俯視量筒,所配制溶液的濃度 。
②將量取液態溶質的量筒用水洗滌,洗滌液倒入容量瓶,所配制溶液的濃度 。
③定容搖勻后,有少量溶液外流,對所配制溶液的濃度 。
查看答案和解析>>
科目:高中化學 來源:2015屆河南省頂級名校高三入學定位考試化學試卷(解析版) 題型:選擇題
下列實驗過程中,始終無明顯現象的是
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
查看答案和解析>>
科目:高中化學 來源:2015屆河南省頂級名校高三入學定位考試化學試卷(解析版) 題型:選擇題
能在溶液中大量共存的一組離子是
A.NH4+ 、Ag+、PO43-、Cl- B.Fe3+、H+、I-、HCO3-
C.K+、Na+、NO3- 、MnO4- D.Al3+、Mg2+ 、SO42- 、CO32-
查看答案和解析>>
科目:高中化學 來源:2015屆河南省偃師市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
將一定量的鐵粉加入到一定濃度的稀硝酸中,金屬恰好完全溶解,反應后溶液中存在:
c(Fe2+)∶c(Fe3+)=3∶2,則參加反應的Fe和HNO3的物質的量之比為
A.1∶1B.5∶16C.2∶3 D.3∶2
查看答案和解析>>
科目:高中化學 來源:2015屆河南省偃師市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
不能用來鑒別Na2CO3和NaHCO3兩種白色固體的實驗操作是
A.分別在這兩種物質的溶液中,加入少量澄清石灰水
B.分別加熱這兩種固體,將生成的氣體通入澄清石灰水中
C.分別在這兩種物質的溶液中,加入少量氯化鈣溶液
D.分別在這兩種物質的等濃度的溶液中,加入少量的稀鹽酸
查看答案和解析>>
科目:高中化學 來源:2015屆河北省邯鄲市高三第一次調研考試化學試卷(解析版) 題型:填空題
實驗室需要配制0.5 mol·L-1的燒堿溶液500 mL,根據溶液配制的過程,回答下列問題:
(1)實驗中除了托盤天平(帶砝碼)、藥匙、量筒和玻璃棒外,還需要的其他玻璃儀器有:________________________________________;
(2)根據計算得知,所需NaOH固體的質量為________g;
(3)配制溶液的過程中,有以下操作。其中正確的是________(填代號)。
A.將氫氧化鈉固體放在紙片上稱量
B.在燒杯中溶解氫氧化鈉固體后,立即將溶液倒入容量瓶中
C.將溶解氫氧化鈉的燒杯用蒸餾水洗滌2~3次,并將洗滌液轉移到容量瓶中
查看答案和解析>>
科目:高中化學 來源:2015屆河北省“五個一名校聯盟”高三教學質量監測(一)化學試卷(解析版) 題型:填空題
(10分)
(1)制備氫氧化鐵膠體的化學方程式為 。
(2)碳酸氫鈉在水溶液中的電離方程式為 。
(3)能證明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事實是 (填選項字母)。
HSO3-+OH-水解平衡的事實是 (填選項字母)。
A.滴入酚酞溶液變紅,再加入H2SO4溶液后紅色退去
B.滴入酚酞溶液變紅,再加入氯水后紅色退去
C.滴入酚酞溶液變紅,再加入BaCl2溶液后產生沉淀且紅色褪去
(4)現有可逆反應:2A(g)+2B(g) C(g)+3D(s),在密閉容器的容積、溫度都相同的條件下,分別從以下兩條途徑建立平衡:Ⅰ. A、B的起始物質的量均為2 mol,Ⅱ.C、D的起始物質的量分別為2 mol和6 mol。以下說法中正確的是 (填選項字母)。
C(g)+3D(s),在密閉容器的容積、溫度都相同的條件下,分別從以下兩條途徑建立平衡:Ⅰ. A、B的起始物質的量均為2 mol,Ⅱ.C、D的起始物質的量分別為2 mol和6 mol。以下說法中正確的是 (填選項字母)。
A.Ⅰ、Ⅱ兩條途徑最終達到平衡時,體系內混合氣體的百分組成相同
B.達到平衡時,途徑Ⅱ所得混合氣密度為途徑Ⅰ所得混合氣密度的2倍
C.達到平衡時,途徑ⅡC的平衡濃度大于途徑ⅠC的平衡濃度的2倍
(5)在恒容絕熱(不與外界交換能量)條件下進行2A (g)+ B(g) 2C(g)+ D(s)反應,按下表數據投料,反應達到平衡狀態,測得體系壓強升高。簡述該反應的平衡常數與溫度的變化關系: 。
2C(g)+ D(s)反應,按下表數據投料,反應達到平衡狀態,測得體系壓強升高。簡述該反應的平衡常數與溫度的變化關系: 。
物質 | A | B | C | D |
起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com