
某有機物0.1mol,與標準狀況下5.6L氧氣充分反應后,產物為CO、CO2、H2O的混合氣體。將此混合氣體通過濃硫酸,濃硫酸增重5.4g,再通過灼熱氧化銅粉末,氧化銅質量減少1.6g;最后通過足量堿石灰,堿石灰增重8.8g。求該有機物的分子式。(書寫計算過程)
C2H6O
【解析】
試題分析:混合氣體通過濃硫酸,濃硫酸增重5.4g,說明水的質量為5.4g,即
n(H2O)=5.4/18mol=0.3mol,即n(H)=0.6mol;
通過足量堿石灰,堿石灰增重8.8g,所以n(CO2)=8.8/44mol=0.2mol
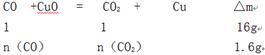
n(CO)=0.1mol,生成的 n(CO2)=0.1mol,有機物燃燒生成的CO2的物質的量為0.2mol-0.1mol=0.1mol,
0.1mol烴中含:0.6molH,0.2molC,
根據質量守恒:m(烴)+m(O2)=m(CO2)+m(CO)+m(H2O),
即:m(烴)+5.6/22.4×32 =0.1×44+0.1×28+0.3×18,
m(烴)=4.6g,
M(烴)=4.6/0.1=46g/mol,
則1mol烴中含有2molC,6molH,還應含有O元素,n(O)=(46-2×12-1×6)/16=1mol
所以有機物的分子式為C2H6O,
考點:有機物的計算
點評:本題考查了有機物的計算,本題側重考查考生的分析和計算能力,該題難度中等。


 步步高達標卷系列答案
步步高達標卷系列答案科目:高中化學 來源:物理教研室 題型:038
查看答案和解析>>
科目:高中化學 來源: 題型:038
某有機物0.1mol和標準狀況下的氧氣5.6L恰好反應,所得產物為二氧化碳、一氧化碳和水蒸氣。將產物通過濃硫酸,結果濃硫酸增重5.4g;再通過灼熱的氧化銅固體,固體質量減輕1.6g;最后通過氫氧化鈉固體,固體質量增加8.8g。假設每步處理均反應(吸收)完全,試通過計算求該有機物的分子式,并寫出其結構簡式。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年黑龍江省哈三中高一下學期期末考試化學試卷(帶解析) 題型:計算題
某有機物0.1mol,與標準狀況下5.6L氧氣充分反應后,產物為CO、CO2、H2O的混合氣體。將此混合氣體通過濃硫酸,濃硫酸增重5.4g,再通過灼熱氧化銅粉末,氧化銅質量減少1.6g;最后通過足量堿石灰,堿石灰增重8.8g。求該有機物的分子式。(書寫計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
某有機物0.1mol,與標準狀況下5.6L氧氣充分反應后,產物為CO、CO2、H2O的混合氣體。將此混合氣體通過濃硫酸,濃硫酸增重5.4g,再通過灼熱氧化銅粉末,氧化銅質量減少1.6g;最后通過足量堿石灰,堿石灰增重8.8g。求該有機物的分子式。(書寫計算過程)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com