
 納米TiO2在涂料、光催化、化妝品等領域有著極其廣泛的應用,制備納米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,經過濾、水洗除去其中的Cl-,再烘干、焙燒除去水分得到粉體TiO2.用現代分析儀器測定TiO2粒子的大小.用氧化還原滴定法測定TiO2的質量分數:一定條件下,將TiO2溶解并還原為Ti3+,再以KSCN溶液作指示劑,用NH4Fe(SO4)2標準溶液滴定Ti3+至全部生成Ti4+.
納米TiO2在涂料、光催化、化妝品等領域有著極其廣泛的應用,制備納米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,經過濾、水洗除去其中的Cl-,再烘干、焙燒除去水分得到粉體TiO2.用現代分析儀器測定TiO2粒子的大小.用氧化還原滴定法測定TiO2的質量分數:一定條件下,將TiO2溶解并還原為Ti3+,再以KSCN溶液作指示劑,用NH4Fe(SO4)2標準溶液滴定Ti3+至全部生成Ti4+.分析 (1)TiCl4水解生成TiO2•xH2O和氯化氫,根據物質的性質和質量守恒定律書寫化學方程式;
(2)檢驗沉淀是否洗凈的方法是,取少量洗滌液,檢驗溶液中溶解的離子是否還存在氯離子;
(3)鐵離子水解易使配制溶液變渾濁,應加對應酸抑制水解,依據配制溶液實驗過程和步驟分析,需要的儀器一定使用容量瓶和膠頭滴管;
(4)用NH4Fe(SO4)2標準溶液滴定Ti3+至全部生成Ti4+,鐵離子變化為亞鐵離子,因為是用KSCN作指示劑,終點時NH4Fe(SO4)2不再反應,滴入最后一滴會生成血紅色的Fe(SCN)3;
(5)根據得失電子守恒,有:1Ti3+~1Fe3+,故n(Fe3+)=n(Ti3+)=n(TiO2)=cV×10-3mol,據此計算其質量分數為;
(6)①NH4Fe(SO4)2溶液濺出,其物質的量濃度減小,消耗的體積增大,百分含量偏大;
②若終點俯視滴定管,讀取的體積比實際消耗的體積偏小,質量分數偏小.
解答 解:(1)設TiCl4的系數為1,根據元素守恒,TiO2•xH2O的系數為1,HCl的系數為4;再根據O元素守恒,可知H2O的系數為(2+x),反應為TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl;
故答案為:TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl;
(2)沉淀吸附溶液中的Cl-,根據發生反應:Cl-+Ag+═AgCl↓,取少量洗滌液,檢驗溶液中溶解的離子是否還存在;
故答案為:取少量水洗液,滴加AgNO3溶液,不產生白色沉淀,說明Cl-已除凈;
(3)鐵離子水解易使配制溶液變渾濁,應加對應酸抑制水解應抑制水解,不引入雜質,所以加硫酸抑制NH4Fe(SO4)2水解,配制溶液用的儀器除天平、藥匙、玻璃棒、燒杯、量簡外,還需容量瓶和膠頭滴管,故選ac;
故答案為:抑制NH4Fe(SO4)2水解;ac;
(4)Fe3+與Ti3+反應,被還原為Fe2+,加入KSCN不顯紅色,當達到滴定終點時,再加入NH4Fe(SO4)2,溶液中Fe3+過量,所以滴入最后一滴NH4Fe(SO4)2,溶液會生成血紅色的Fe(SCN)3,溶液會變成紅色;
故答案為:溶液變為紅色;
(5)根據得失電子守恒,有:1Ti3+~1Fe3+,故n(Fe3+)=n(Ti3+)=n(TiO2)=cV×10-3mol,其質量分數=$\frac{CV×1{0}^{-3}mol×Mg/mol}{wg}$×100%=$\frac{CVM}{1000w}$×100%;
故答案為:$\frac{CVM}{1000w}$×100%;
(6)①NH4Fe(SO4)2溶液濺出,其物質的量濃度減小,消耗的體積增大,則測定結果中百分含量偏高,故答案為:偏高;
②若終點俯視滴定管,讀取的體積比實際消耗的體積偏小,質量分數偏小,故答案為:偏低.
點評 本題考查物質含量的探究性實驗,涉及基本操作、離子檢驗和氧化還原滴定等,把握水解原理、氧化還原滴定法原理為解答的關鍵,側重分析能力及遷移應用能力的考查,注意對實驗原理的理解與對基本操作的掌握,題目難度中等.


 一線名師提優試卷系列答案
一線名師提優試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3COOH和HCOOCH3 | D. | CH3CH2CHO和CH3COCH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3分子是非極性分子 | |
| B. | 分子內3個N-H鍵的鍵長相等,鍵角相等 | |
| C. | NH3分子內3個N-H鍵的鍵長相等,3個鍵角都等于107°18′ | |
| D. | NH3分子內3個N-H鍵的鍵長相等,3個鍵角都等于120° |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
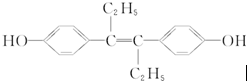
| A. | 它易溶于有機溶劑 | |
| B. | 可與NaOH和Na2CO3溶液發生反應 | |
| C. | 該有機物分子中一定有14個碳原子共平面 | |
| D. | 1 mol該有機物可與5 mol Br2發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | R(OH)3 | B. | R2O7 | C. | HRO3 | D. | H2R |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 它是一種共價化合物 | |
| B. | 在加熱時此化合物不能分解 | |
| C. | 這種化合物不能跟堿反應 | |
| D. | 這種化合物可以由PH3和HI化合而成 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com