
(6分)已知:①1mol H2中的共價鍵斷裂吸收436KJ能量,0.5mol O2中的共價鍵斷裂吸收249KJ能量,形成1mol水蒸氣中的共價鍵釋放930KJ 能量。
②H2O(l)=H2O(g) ΔH=+44 kJ·mol-1
③CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H = -890 kJ·mol-1
(1)寫出H2 在O2中燃燒生成水蒸氣的熱化學方程式 ;
(2)1.12L(折算成標況下的體積)H2完全燃燒生成液態水放出的熱量為 ;
(3)實驗測得氫氣和甲烷的混合氣體共4 mol完全燃燒時放熱為2358kJ(生成的水為液態),則混合氣體中氫氣和甲烷的體積比為 。
(每小題2分)(1)H2(g)+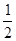 O2(g)==H2O(g) △H= -245kJ/mol
O2(g)==H2O(g) △H= -245kJ/mol
(2)14.45KJ (3)1:1
【解析】考查反應熱放熱計算及熱化學方程式的書寫
(1)反應熱就是斷鍵吸收的能量和形成化學鍵所放出的能量的差值,因此反應熱是436KJ/mol+249KJ/mol-930KJ/mol=245kJ/mol,所以反應的熱化學方程式是H2(g)+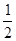 O2(g)==H2O(g) △H= -245kJ/mol。
O2(g)==H2O(g) △H= -245kJ/mol。
(2)標準狀況下1.12L氫氣是0.05mol,燃燒生成水蒸氣放熱是245kJ/mol×0.05mol=12.25kJ。生成水蒸氣是0.05mol,變成液態水又放出熱量是44kJ/mol×0.05mol=2.2kJ,所以最終放出的熱量是12.25kJ+2.2kJ=14.45KJ。
(3)設混合氣體中氫氣和甲烷的物質的量分別是x和y,則x+y=4mol。根據熱化學方程式可知,289kJ/mol×x+890 kJ/mol×y=2358kJ,解得x=y=2mol,所以二者的體積之比是1:1。


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 2NH3中,每生成2mol NH3,
2NH3中,每生成2mol NH3,查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com