
【題目】M被廣泛用于醫藥、香料的合成,其一種合成路線如下(反應試劑與反應條件已省略):

已知A與B互為同分異構體。完成下列填空:
(1)寫出M中含氧官能團的名稱:__________。1mol D最多能與___________mol ![]() 發生加成反應。
發生加成反應。
(2)反應②所需試劑與條件是______________。反應③的反應類型是__________________。
(3)寫出結構簡式。A ___________________C _______________________
(4)寫出檢驗D已完全轉化為M的方法。___________________。
(5)寫出兩種符合下列要求的M的同分異構體的結構簡式。 _____________
i. 苯環上的一氯代物只有兩種 ii. 能發生水解反應 iii. 分子中含有兩個甲基
(6)有人認為僅用反應①就能得到B,但事實證明產物中B的含量遠遠小于A,由此可以得到的結論是:_____________________。
【答案】 羧基 4 NaOH醇溶液,加熱 氧化反應 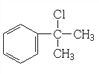
 取樣,加氫氧化鈉將溶液調節至堿性,向其中加入新制氫氧化銅懸濁液,加熱,若無磚紅色沉淀產生,說明D已完全轉化為M。
取樣,加氫氧化鈉將溶液調節至堿性,向其中加入新制氫氧化銅懸濁液,加熱,若無磚紅色沉淀產生,說明D已完全轉化為M。  ;
; 烷基發生取代反應時,含氫原子較少的碳原子上的氫原子易被取代
烷基發生取代反應時,含氫原子較少的碳原子上的氫原子易被取代
【解析】根據流程圖,B(鹵代烴)能夠反應生成醇,進一步氧化生成醛,則B為![]() ,A與B互為同分異構體,則A為
,A與B互為同分異構體,則A為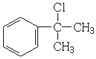 。
。
(1)M為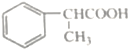 ,其中含氧官能團實羧基。D為
,其中含氧官能團實羧基。D為 ,含有1mol醛基和1mol苯環,1mol D最多能與4mol
,含有1mol醛基和1mol苯環,1mol D最多能與4mol ![]() 發生加成反應,故答案為:羧基;3;
發生加成反應,故答案為:羧基;3;
(2)反應②為 發生消去反應生成
發生消去反應生成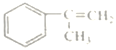 ,所需試劑與條件為NaOH醇溶液,加熱。反應③是
,所需試劑與條件為NaOH醇溶液,加熱。反應③是 氧化生成
氧化生成 的反應,故答案為:NaOH醇溶液,加熱;氧化反應;
的反應,故答案為:NaOH醇溶液,加熱;氧化反應;
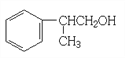
(3)根據上述分析,A 為 ;B為
;B為![]() ,B發生水解反應生成C,C為
,B發生水解反應生成C,C為![]() ,故答案為:
,故答案為: ;
;![]() ;
;
(4)D為 ,M為
,M為 ,檢驗D已完全轉化為M,只需要檢驗混合物中不存在醛基,方法為取樣,加氫氧化鈉將溶液調節至堿性,向其中加入新制氫氧化銅懸濁液,加熱,若無磚紅色沉淀產生,說明D已完全轉化為M,故答案為:取樣,加氫氧化鈉將溶液調節至堿性,向其中加入新制氫氧化銅懸濁液,加熱,若無磚紅色沉淀產生,說明D已完全轉化為M;
,檢驗D已完全轉化為M,只需要檢驗混合物中不存在醛基,方法為取樣,加氫氧化鈉將溶液調節至堿性,向其中加入新制氫氧化銅懸濁液,加熱,若無磚紅色沉淀產生,說明D已完全轉化為M,故答案為:取樣,加氫氧化鈉將溶液調節至堿性,向其中加入新制氫氧化銅懸濁液,加熱,若無磚紅色沉淀產生,說明D已完全轉化為M;
(5)M為 ,i. 苯環上的一氯代物只有兩種,說明苯環上有2個處于對位的取代基; ii. 能發生水解反應,說明屬于酯類; iii. 分子中含有兩個甲基;符合要求的M的同分異構體有
,i. 苯環上的一氯代物只有兩種,說明苯環上有2個處于對位的取代基; ii. 能發生水解反應,說明屬于酯類; iii. 分子中含有兩個甲基;符合要求的M的同分異構體有 、
、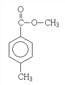 ,故答案為:
,故答案為: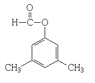 、
、 ;
;
(6)烷基發生取代反應時,含氫原子較少的碳原子上的氫原子易被取代,僅用反應①得到的產物中B的含量遠遠小于A,故答案為:烷基發生取代反應時,含氫原子較少的碳原子上的氫原子易被取代。


科目:高中化學 來源: 題型:
【題目】在食品中的一些元素含量偏高會引起毒性反應,食品衛生法對它們的含量最高標準有極嚴格規定,這些元素是
①Na ②Mg ③As砷 ④Cd鎘 ⑤Ca ⑥Zn ⑦Hg ⑧Pb ⑨Cu ⑩K中的
A.②④⑥⑦⑧ B.②④⑥⑧⑨
C.⑥⑦⑧⑨⑩ D.③④⑦⑧⑨
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1mol過氧化鈉與2mol碳酸氫鈉固體混合后,在密閉的容器中加熱充分反應,排出氣體物質后冷卻,殘留的固體物質是
A.Na2CO3 B.Na2O2 、Na2CO3 C.NaOH 、Na2CO3 D.Na2O2 、NaOH 、Na2CO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣脫硝脫碳主要原理為: ![]()
![]()
![]() 。一定條件下密閉容器中,用傳感器測得該反應在不同時間NO和CO濃度如下表:
。一定條件下密閉容器中,用傳感器測得該反應在不同時間NO和CO濃度如下表:
時間/s | 0 | 1 | 2 | 3 | 4 |
|
|
|
|
|
|
|
|
|
|
|
|
完成下列填空:
(1)寫出該反應的平衡常數表達式:__________________。
(2)前2s內的氮氣的平均反應速率是: ![]() =___________
=___________ ![]() ;
;
達到平衡時,CO的轉化率為_______________。
(3)工業上常采用“低溫臭氧氧化脫硫脫硝”技術來同時吸收![]() 和氮的氧化物氣體(
和氮的氧化物氣體(![]() ),以獲得
),以獲得![]() 的稀溶液。在此溶液中,水的電離程度是受到了_________(填“促進”、“抑制”或“沒有影響”);若往
的稀溶液。在此溶液中,水的電離程度是受到了_________(填“促進”、“抑制”或“沒有影響”);若往![]() 溶液中再加入少量稀鹽酸,則
溶液中再加入少量稀鹽酸,則![]() 值將__________(填“變大”、“變小”或“不變”)。
值將__________(填“變大”、“變小”或“不變”)。
(4)如果向![]() 溶液中通入足量
溶液中通入足量![]() 氣體,沒有沉淀生成,繼續滴加一定量的氨水后,則會生成白色沉淀。用平衡移動原理解釋上述現象。_________________________。
氣體,沒有沉淀生成,繼續滴加一定量的氨水后,則會生成白色沉淀。用平衡移動原理解釋上述現象。_________________________。
(5)向另一種可溶性鋇鹽溶液中通入少量![]() 氣體,會立即看到白色沉淀,該沉淀的化學式為_________;原可溶性鋇鹽可能是_________________。
氣體,會立即看到白色沉淀,該沉淀的化學式為_________;原可溶性鋇鹽可能是_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述錯誤的是
①熱穩定性:H2O> HF> H2S ②最外層兩個電子的元素 , 不一定在第IIA族
③IIA族元素的陽離子與上一周期稀有氣體元素的原子具有相同的核外電子排布
④元素周期表中從ⅢB族到ⅡB族10個縱行的元素都是金屬元素
⑤多電子原子中, 在離核較近的區域內運動的電子能量較高
⑥氯的各種含氧酸的酸性由弱到強排列為 HClO<HClO2<HClO3<HClO4
⑦兩個非金屬元素原子間只可能形成共價鍵, 而含金屬元素的化合物中一定含離子鍵
A. ②④⑥ B. ①⑤⑥ C. ②③④ D. ①⑤⑥⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用化學原理對工廠排放的廢水等進行有效檢測與合理處理。某工廠處理含+6價鉻的污 水工藝的流程如下:

(1)請寫出N2H4的電子式____________________。
(2)下列溶液中,可以代替上述流程中N2H4的是______________(填選項序號)。
A. FeSO4溶液 B.濃硝酸 C.酸性KMnO4溶液 D. Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4轉化為無污染的物質,則該反應中氧化劑與還原劑的物質的量之比為________________。
(4)Cr(OH)3的化學性質與A1(OH)3相似。在上述生產過程中加入NaOH溶液時要控制溶液的pH不能過高,原因可用離子方程式表示為_______________________________。
(5)實際工業生產中,有時還可采用陽離子交換樹脂法來測定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR為陽離子交換樹脂,Mn+為要測定的離子(此時氫離子不參與交換)。常溫下,將pH=5的廢水經過陽離子交換樹脂后,測得溶液中Na+比交換前增加了0.046 g·L-1,則該條件下Cr(OH)3的Ksp的值為___________________________。
(6)在實際的含鉻廢水處理中,還可采用直接沉淀的方法,處理成本較低。
①己知含鉻廢水中存在著平衡,Cr2O72-和CrO42-在溶液中可相互轉化,請用離子方程式表示它們之間的轉化反應____________________________。
②在實際工業生產中,加入沉淀劑BaCl2溶液之前還要加入一定量的NaOH,這樣有利于沉淀的生成,則生成沉淀的化學式為__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“納米材料”是粒子直徑為1~100nm的材料,納米碳就是其中一種.若將納米碳均勻地分散到蒸餾水中,所形成的分散系:①是溶液 ②是膠體 ③能產生丁達爾效應 ④分散質粒子能透過濾紙 ⑤分散質粒子不能透過濾紙 ⑥靜置后,會析出黑色沉淀( )
A.①④⑥
B.②③④
C.②③⑤
D.①⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學—選修5:有機化學基礎】
維拉佐酮是臨床上使用廣泛的抗抑郁藥,其關鍵中間體G的合成路線如下:
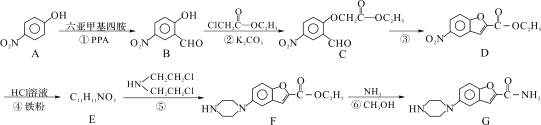
已知:![]()
請回答下列問題:
(1)C中含氧官能團的名稱_________。(任寫兩種)
(2)反應④的反應類型是:_________,G的分子式為:_________。
(3)下列有關說法錯誤的是_________。
a.B遇FeCl3溶液顯紫色且能發生銀鏡反應
b.A、B兩種物質不可用核磁共振氫譜或紅外光譜區別
c.C能發生取代、加成、氧化、還原反應
d.1 mol D能與2 mol NaOH反應
(4)反應②的化學方程式:_________;反應②加入K2CO3的作用是_________。
(5)寫出同時滿足下列條件B的一種同分異構體的結構簡式:_________。
①能發生銀鏡反應
②能發生水解反應,其水解產物之一能與FeCl3溶液發生顯色反應
③核磁共振氫譜有三組峰
(6)已知:![]()
請以甲苯、乙醇等為原料制備 ![]() ,寫出相應的合成路線流程圖(無機試劑任用,合成路線流程圖示例見題干)______
,寫出相應的合成路線流程圖(無機試劑任用,合成路線流程圖示例見題干)______
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com