
完成下列熱化學方程式(化學方程式、電極反應式、表達式等)的書寫:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1,
C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1,
Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
用炭粉在高溫條件下還原CuO生成Cu2O的熱化學方程式是:
(2)在一定條件下,二氧化硫和氧氣發生如下反應:2SO2(g)+O2(g) 2SO3(g),寫出該反應的化學平衡常數表達式:
2SO3(g),寫出該反應的化學平衡常數表達式:
(3)以甲烷、空氣為反應物,KOH溶液作電解質溶液構成燃料電池,則負極反應式為: 。
(4)無水AlCl3瓶蓋打開有白霧,其反應的化學方程式為 。
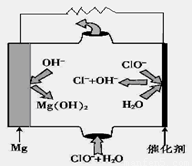
(5)“鎂—次氯酸鹽”燃料電池,其裝置示意圖如圖,該電池反應的總反應方程式為_____________________。
(6)工業上電解飽和食鹽水的離子方程式為________________。
(12分)(1)2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =+34.5 kJ·mol-1 (2分)
(2)K= c2(SO3)/ c2(SO2) c (O2) (2分)
(3)CH4+10OHˉ—8eˉ=CO32ˉ+7H2O, (2分)
(4)AlCl3+3H2O Al(OH)3+3HCl (2分)
Al(OH)3+3HCl (2分)
(5)Mg+ClO-+ H2O= Cl-+Mg(OH)2 (2分)
(6)2Clˉ+2H2O 2OHˉ+Cl2↑+H2↑ (2分)
2OHˉ+Cl2↑+H2↑ (2分)
【解析】
試題分析:(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H=-169kJ·mol-1,
②C(s)+1/2O2(g)=CO(g);△H=-110.5kJ·mol-1,
③Cu(s)+1/2O2(g)=CuO(s);△H=-157kJ·mol-1
由蓋斯定律可知,①-③×2+②得2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=-169kJ·mol-1-(-157kJ·mol-1)×2=-110.5kJ·mol-1=+34.5 kJ·mol-1.
故答案為:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=+34.5 kJ·mol-1.
(2)可逆反應2SO2(g)+O2(g) 2SO3(g)的化學平衡常數
2SO3(g)的化學平衡常數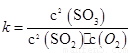
故答案為: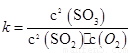
(3)原電池負極發生氧化反應,甲烷在負極放電,氧氣在正極反應,堿性條件下氧氣放電生成氫氧根離子,正極電極反應式為2O2+4H2O+8e-=8OH-,總的電池反應式為CH4+2O2+2OHˉ=CO32ˉ+3H2O,電池總反應式減去正極電極反應式可得負極電極反應式為CH4+10OHˉ-8eˉ=CO32ˉ+7H2O.
故答案為:CH4+10OHˉ-8eˉ=CO32ˉ+7H2O.
(4)AlCl3水解AlCl3+3H2O Al(OH)3+3HCl生成HCl,氯化氫與空氣中的水蒸氣呈白霧.
Al(OH)3+3HCl生成HCl,氯化氫與空氣中的水蒸氣呈白霧.
故答案為:AlCl3+3H2O Al(OH)3+3HCl.
Al(OH)3+3HCl.
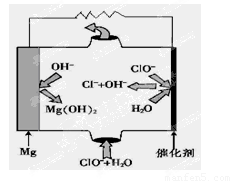
(5)由圖可知鎂-次氯酸鹽”燃料電池中Mg與ClO-、H2O反應生成Cl-與Mg(OH)2,該電池反應的總反應方程式為Mg+ClO-+H2O=Cl-+Mg(OH)2.
故答案為:Mg+ClO-+H2O=Cl-+Mg(OH)2.
(6)電解飽和食鹽水生成氯氣、氫氣、氫氧化鈉,電解飽和食鹽水的離子方程式為2Clˉ+2H2O 2OHˉ+Cl2↑+H2↑.
2OHˉ+Cl2↑+H2↑.
故答案為:2Clˉ+2H2O 2OHˉ+Cl2↑+H2↑
2OHˉ+Cl2↑+H2↑
考點:用蓋斯定律進行有關反應熱的計算;原電池和電解池的工作原理;化學平衡常數的含義


 小學課堂作業系列答案
小學課堂作業系列答案 金博士一點全通系列答案
金博士一點全通系列答案科目:高中化學 來源: 題型:
 完成下列熱化學方程式(化學方程式、電極反應式、表達式等)的書寫:
完成下列熱化學方程式(化學方程式、電極反應式、表達式等)的書寫:| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| c2(SO3) |
| c2(SO2)?c(O2) |
| c2(SO3) |
| c2(SO2)?c(O2) |
 Al(OH)3+3HCl
Al(OH)3+3HCl Al(OH)3+3HCl
Al(OH)3+3HCl
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
(4分)已知25℃、101kpa時,一些物質的燃燒熱為:
| 化學式 | CO(g) | H2(g) | CH3OH(l) |
| △H/(KJ/mol) | -283.0 | -285.8 | -726.5 |
(1)寫出該條件下CH3OH(l)完全燃燒的熱化學方程式: 。
(2)根據蓋斯定律完成下列熱化學方程式 CO(g)+ 2H2(g)= CH3OH(l) △H=
查看答案和解析>>
科目:高中化學 來源:2010年福建省季延中學高二下學期期末考試化學試題 題型:填空題
(4分)已知25℃、101kpa時,一些物質的燃燒熱為:
| 化學式 | CO(g) | H2(g) | CH3OH(l) |
| △H/(KJ/mol) | -283.0 | -285.8 | -726.5 |
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省高二上學期期中考試化學試卷(選修)(解析版) 題型:填空題
完成下列熱化學方程式(化學方程式、電極反應式、表達式等)的書寫:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=-169kJ·mol-1,
C(s)+1/2O2(g)=CO(g);△H=-110.5kJ·mol-1,
Cu(s)+1/2O2(g)=CuO(s);△H=-157kJ·mol-1
用炭粉在高溫條件下還原CuO生成Cu2O的熱化學方程式是:
(2)在一定條件下,二氧化硫和氧氣發生如下反應:2SO2(g)+O2(g) 2SO3(g),寫出該反應的化學平衡常數表達式:
2SO3(g),寫出該反應的化學平衡常數表達式:
(3)以甲烷、空氣為反應物,KOH溶液作電解質溶液構成燃料電池,則負極反應式為: 。
(4)鐵在潮濕的空氣中發生吸氧腐蝕的電池反應方程式為 。
(5)“鎂—次氯酸鹽”燃料電池,其裝置示意圖如圖,該電池反應的總反應方程式為_______________ 。
(6)工業上電解熔融氯化鈉的方程式為 。
查看答案和解析>>
科目:高中化學 來源:2010年福建省高二下學期期末考試化學試題 題型:填空題
(4分)已知25℃、101kpa時,一些物質的燃燒熱為:
|
化學式 |
CO(g) |
H2(g) |
CH3OH(l) |
|
△H/(KJ/mol) |
-283.0 |
-285.8 |
-726.5 |
(1)寫出該條件下CH3OH(l)完全燃燒的熱化學方程式: 。
(2)根據蓋斯定律完成下列熱化學方程式 CO(g)+ 2H2(g)= CH3OH(l) △H=
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com