
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:


查看答案和解析>>
科目:高中化學 來源: 題型:
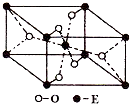 已知A、B、C、D、E五種元素的原子序數依次遞增,A、B、C、D位于前三周期.A位于周期表的s區,其原子中電子層數和未成對電子數相同;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同;D元素是地殼中含量最多的元素.E有“生物金屬”之稱,E4+離子和氬原子的核外電子排布相同.
已知A、B、C、D、E五種元素的原子序數依次遞增,A、B、C、D位于前三周期.A位于周期表的s區,其原子中電子層數和未成對電子數相同;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同;D元素是地殼中含量最多的元素.E有“生物金屬”之稱,E4+離子和氬原子的核外電子排布相同.查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 (2011?丹東模擬) 化學一一選修物質結構與性質
(2011?丹東模擬) 化學一一選修物質結構與性質| Mr | ||
4
|
| Mr | ||
4
|
查看答案和解析>>
科目:高中化學 來源: 題型:
| 熔點/K | 沸點/K | 標準狀況時在水中的溶解度 | |
| 甲 | 187 | 202 | 2.6 |
| 乙 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com