
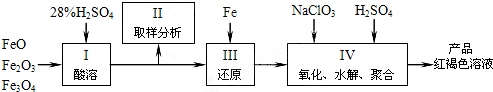
分析 (1)用98%的硫酸配制28%的稀硫酸的實驗步驟是計算、量取、溶解(稀釋),所需的玻璃儀器有量筒、玻璃棒和燒杯;
(2)運用電子得失守恒法以及電荷守恒、質量守恒配離子方程式;
(3)鐵的氧化物用硫酸浸取,得到硫酸亞鐵、硫酸鐵,用Fe還原,再加入氯酸鈉、硫酸進行氧化、水解、聚合得到聚合硫酸鐵,產品紅褐色溶液中可能混有Na2SO4、H2SO4等含SO42-的物質,故欲測定聚合硫酸鐵中SO42-與Fe3+物質的量之比,則應選擇分別測定Fe3+和SO42-的量,故需分別選用試劑NaOH和BaCl2溶液;需要測定的量是最后所得的Fe2O3和BaSO4的質量.
解答 解:(1)用98%的硫酸配制 28% 的稀 硫酸的實驗步驟是計算、量取、溶解(稀釋),所需的玻璃儀器有量筒、玻璃棒和燒杯,
故答案為:AB;
(2)Fe2+由+2價升高到+3價,升高1價,ClO3-中Cl的化合價從+5價降低到-1價,降低6價,可得6Fe2++ClO3-+H+--6Fe3++Cl-,由電荷守恒、質量守恒得:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,
故答案為:6;1;6;6;1;3H2O;
(3)根據題給制取聚合硫酸鐵的流程分析可知,產品紅褐色溶液中可能混有Na2SO4、H2SO4等含SO42-的物質,故欲測定聚合硫酸鐵中SO42-與Fe3+物質的量之比,則應選擇分別測定Fe3+和SO42-的量,故需分別選用試劑NaOH和BaCl2溶液;根據測定Fe2O3來測定Fe3+的物質的量,根據測定 BaSO4的質量來測定SO42-的物質的量,
故答案為:AC; BaSO4.
點評 本題以聚合硫酸鐵的制備為載體,考查溶液配制、氧化還原反應配平、元素化合物知識、化學工藝流程等,是對學生綜合能力的考查,難度中等.


 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:多選題
| A. | 反應物是體積比1:3的乙醇和3mol/L硫酸的混和液 | |
| B. | 溫度計插入反應溶液液面以下,以便控制反應溫度 | |
| C. | 反應容器燒瓶中應加入少許瓷片 | |
| D. | 反應完畢先滅熄滅酒精燈,再從水槽中取出導管 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 )是無色,帶有辛辣氣味的易燃液體,有毒.人體吸入過多的苯乙烯蒸氣時會引起中毒,在空氣中的允許濃度在1×10-4 kg•m-3以下.下列關于苯乙烯的性質推斷中正確的是( )
)是無色,帶有辛辣氣味的易燃液體,有毒.人體吸入過多的苯乙烯蒸氣時會引起中毒,在空氣中的允許濃度在1×10-4 kg•m-3以下.下列關于苯乙烯的性質推斷中正確的是( )| A. | 它能使溴的四氯化碳溶液褪色,但不能使酸性高錳酸鉀溶液褪色 | |
| B. | 它既能使溴的四氯化碳溶液褪色,也能使酸性高錳酸鉀溶液褪色 | |
| C. | 它易溶于水,也易溶于有機溶劑 | |
| D. | 在一定條件下可以發生加聚反應.生成物可用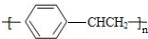 表示 表示 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
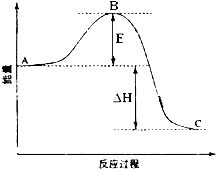 2SO2(g)+O2(g)═2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3的△H=-99kJ•mol-1.請回答下列問題:
2SO2(g)+O2(g)═2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3的△H=-99kJ•mol-1.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平衡不移動 | |
| B. | 再達平衡時,n(A):n(B):n(C)仍為2:2:1 | |
| C. | 再達平衡時,C的體積分數增大 | |
| D. | 若將容器改為恒壓容器,則平衡向右移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3經催化氧化獲得NO | B. | NO2跟水作用制取硝酸 | ||
| C. | NH3+CO2+H2O=NH4HCO3 | D. | N2+O2=2NO(放電條件) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 7.8g Na2S和Na2O2的混合物中含有的陰離子數等于0.1NA | |
| B. | 12.5mL 16mol•L-1濃硫酸與足量銅反應,轉移電子數為0.2NA | |
| C. | 5.6 g鐵粉在0.1mol氯氣中充分燃燒,轉移電子數為0.3NA | |
| D. | 1 mol的甲基與1 mol的銨根離子所含電子數均為10NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
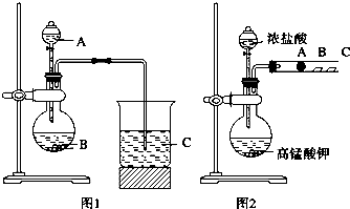
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com