
二甲酸鉀是一種白色晶體,商品名為弗米(Formil),是一種能替代抗生素的促生長劑,化學式為KH(HCOO)2,具有吸濕性,易溶于水。
二甲酸鉀的生產工藝流程如下:
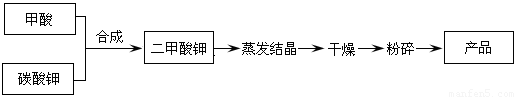
(1)寫出甲酸和碳酸鉀生產二甲酸鉀的化學方程式:???????????????????????????????????????????????????????????? 。
(2)測定某弗米產品純度的實驗方法如下:
稱取該弗米產品2.5g,將其全部溶解在水中,配制成250mL未知濃度的溶液,取出25.00mL于錐形瓶中,再滴加2~3滴指示劑,用0.10mol·L-1的NaOH溶液滴定至終點,消耗NaOH溶液的體積為18.50mL。
①加入的指示劑是???????????? (選填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至終點的現象是???????????????????????????????????????? 。
②上述弗米產品中二甲酸鉀的質量分數為????????????? 。(寫出計算過程)
(1)4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O(2分)
(2)①酚酞(2分)溶液由無色恰好變成淺紅色且在半分鐘內不褪色(2分)
②96.2%(6分)
【解析】
試題分析:(1)足量的甲酸生成酸式鹽,所以碳酸鉀只能生成二氧化碳;(2)終點時氫氧化鈉與二甲酸鉀恰好完全反應生成正鹽,甲酸是弱酸,所以其正鹽水解溶液為堿性,故使用在堿性條件下變色的酚酞做指示劑;終點的現象是溶液由無色恰好變成淺紅色且在半分鐘內不褪色;
(3)KH(HCOO)2+ NaOH=K2(HCOO)2 +Na2(HCOO)2+ H2O
n(KH(HCOO)2)= n(NaOH)= 18.50×10-3×0.10=1.85×10-3mol
產品中二甲酸鉀的質量分數為1.85×10-3×130×10÷2.5=0.962
考點:考查物質的含量的計算分析有關問題。


 陽光課堂課時優化作業系列答案
陽光課堂課時優化作業系列答案科目:高中化學 來源: 題型:閱讀理解

| 反應溫度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 產品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
| 反應物料比 | 2:1 | 3:1 | 4:1 | 5:1 | 6:1 | 7:1 |
| 產品回收率(%) | 0 | 38.4 | 82.6 | 83.6 | 84.5 | 84.8 |
查看答案和解析>>
科目:高中化學 來源:上海中學、復旦附中等八校2011屆高三聯合調研化學試題 題型:058
二甲酸鉀是一種白色晶體,商品名為弗米(Formil),是一種能替代抗生素的促生長劑,化學式為KH(HCOO)2,具有吸濕性,易溶于水.
二甲酸鉀的生產工藝流程如下:
(1)以甲酸和碳酸鉀為原料生產二甲酸鉀,實驗測得反應條件對產品回收率的影響如下:


①寫出甲酸和碳酸鉀生產二甲酸鉀的化學方程式:________.
②實際生產二甲酸鉀時應選擇的最佳反應條件是反應溫度應控制在________℃∽________℃,反應物料比應選擇________.由表1可知反應溫度過高,反應回收率反而會降低,其原因可能是__________.
③蒸發結晶后需進行的操作步驟是________、________.
(2)測定某弗米產品純度的實驗方法如下:
稱取該弗米產品2.5 g,將其全部溶解在水中,配制成250 mL未知濃度的溶液,取出25.00 mL于錐形瓶中,再滴加2~3滴指示劑,用0.10 mol·L-1的NaOH溶液滴定至終點,消耗NaOH溶液的體積為18.50 mL.
①加入的指示劑是________(選填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至終點的現象是________________.
②上述弗米產品中二甲酸鉀的質量分數為________.
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
二甲酸鉀是一種白色晶體,商品名為弗米(Formil),是一種能替代抗生素的促生長劑,化學式為KH(HCOO)2,具有吸濕性,易溶于水。
 |
(1)以甲酸和碳酸鉀為原料生產二甲酸鉀,實驗測得反應條件對產品回收率的影響如下:
表1 反應溫度對產品回收率的影響
| 反應溫度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 產品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
表2 反應物料比對產品回收率的影響
| 反應物料比 | 2∶1 | 3∶1 | 4∶1 | 5∶1 | 6∶1 | 7∶1 |
| 產品回收率(%) | 0 | 38.4 | 82.6 | 83.6 | 84.5 | 84.8 |
備注:表2中反應物料比為甲酸和無水碳酸鉀的物質的量之比。
①寫出甲酸和碳酸鉀生產二甲酸鉀的化學方程式:
。
②實際生產二甲酸鉀時應選擇的最佳反應條件是反應溫度應控制在 ℃∽ ℃,反應物料比應選擇 ∶ 。由表1可知反應溫度過高,反應回收率反而會降低,其原因可能是 。
(2)測定某弗米產品純度的實驗方法如下:
稱取該弗米產品2.5g,將其全部溶解在水中,配制成250mL未知濃度的溶液,取出25.00mL于錐形瓶中,再滴加2~3滴指示劑,用0.10mol·L-1的NaOH溶液滴定至終點,消耗NaOH溶液的體積為18.50mL。
①加入的指示劑是 (選填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至終點的現象是 。
②上述弗米產品中二甲酸鉀的質量分數為 。
查看答案和解析>>
科目:高中化學 來源:江蘇省無錫市2010年高三教學情況調查(一) 題型:填空題
二甲酸鉀是一種白色晶體,商品名為弗米(Formil),是一種能替代抗生素的促生長劑,化學式為KH(HCOO)2,具有吸濕性,易溶于水。
 |
(1)以甲酸和碳酸鉀為原料生產二甲酸鉀,實驗測得反應條件對產品回收率的影響如下:
表1 反應溫度對產品回收率的影響
|
反應溫度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
產品回收率(%) |
75.6 |
78.4 |
80.6 |
82.6 |
83.1 |
82.1 |
73.7 |
表2 反應物料比對產品回收率的影響
|
反應物料比 |
2∶1 |
3∶1 |
4∶1 |
5∶1 |
6∶1 |
7∶1 |
|
產品回收率(%) |
0 |
38.4 |
82.6 |
83.6 |
84.5 |
84.8 |
備注:表2中反應物料比為甲酸和無水碳酸鉀的物質的量之比。
①寫出甲酸和碳酸鉀生產二甲酸鉀的化學方程式:
。
②實際生產二甲酸鉀時應選擇的最佳反應條件是反應溫度應控制在 ℃∽ ℃,反應物料比應選擇 ∶ 。由表1可知反應溫度過高,反應回收率反而會降低,其原因可能是 。
(2)測定某弗米產品純度的實驗方法如下:
稱取該弗米產品2.5g,將其全部溶解在水中,配制成250mL未知濃度的溶液,取出25.00mL于錐形瓶中,再滴加2~3滴指示劑,用0.10mol·L-1的NaOH溶液滴定至終點,消耗NaOH溶液的體積為18.50mL。
①加入的指示劑是 (選填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至終點的現象是 。
②上述弗米產品中二甲酸鉀的質量分數為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com