
| A. | 1mol | B. | 1.33mol | C. | 0.667mol | D. | 0mol |
分析 SO42-+Ba2+=BaSO4↓,所以向含有1mol KAl(SO4)2的溶液中加入適量的Ba(OH)2溶液,使SO42-恰好轉化為沉淀,則加入的氫氧化鋇為2mol,所以Al3+與OH-物質的量分別為1mol、4mol,恰好反應Al3++4OH-=A1O2-+2H2O,沒有沉淀生成.
解答 解:溶液含有1mol KAl(SO4)2,所以含有SO42-2mol.加入適量的Ba(OH)2溶液,使SO42-恰好轉化為沉淀,
由反應SO42-+Ba2+=BaSO4↓可知,加入的氫氧化鋇含有2molBa2+,即需加入2molBa(OH)2.
由于溶液含有1mol KAl(SO4)2,則含有1molAl3+,加入2molBa(OH)2,提供4molOH-,恰好反應Al3++4OH-=A1O2-+2H2O,沒有沉淀生成.
故選:D.
點評 本題考查離子方程式的有關計算,難度中等,關鍵清楚發生反應的本質,根據SO42-恰好轉化為沉淀判斷加入Ba(OH)2的物質的量.


科目:高中化學 來源: 題型:選擇題
| A. | 反應Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3•H2O+8H2O過程中的能量變化情況符合如圖 | |
| B. | 氫氧燃料電池的總反應為:2H2+O2=2H2O | |
| C. | 化學平衡狀態指的是反應物和生成物濃度不再改變時的狀態 | |
| D. | 催化劑既能加快化學反應速率,又能提高原料利用率或轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
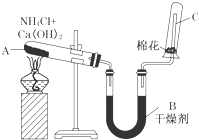 實驗室中用如圖所示裝置制取干燥的氨氣.
實驗室中用如圖所示裝置制取干燥的氨氣.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
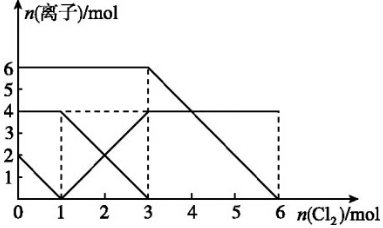
| A. | 還原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物質的量為3 mol | |
| C. | 當通入1mol Cl2時,溶液中已發生的反應為2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 根據HA、HB的電離常數的相對大小可以直接判斷兩種溶液的酸性強弱 | |
| B. | 常溫下2S2O(g)=3S(s)+SO2(g)能自發進行,可推斷該反應為放熱反應 | |
| C. | 加入硫酸銅可使鋅與稀硫酸的反應速率加快,說明Cu2+具有催化作用 | |
| D. | 將濃硫酸和濃硝酸混合后立即放入鐵片,鐵片被鈍化的效果一定會更好 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10-3 | B. | 10-11 | C. | 10-14 | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗方案(只要求填寫選用試劑) | ① | ② |
| 填試劑序號 | 填試劑序號 | |
| 實驗現象 | 一支試管中有白色沉淀,另一支試管中先生成白色沉淀,后白色沉淀消失 | 溶液由無色變為黃色(或橙黃) |
| 有關反應的離子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO2-+H2O 或③Al3++4OH-═AlO2-+2H2O ④Mg2++2OH-═Mg(OH)2↓ | Cl2+2Br-=2Cl-+Br2 |
| 結論 | 金屬性:Mg>Al | 非金屬性:Cl>Br |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com