
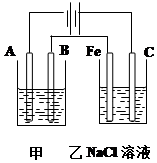
 如圖為相互串聯的甲乙兩個電解池,請回答:
如圖為相互串聯的甲乙兩個電解池,請回答:分析 圖示是兩個串聯的電解池,依據電源判斷A為陰極,B為陽極,Fe為陰極,C為陽極;
(1)依據電解原理精煉銅的裝置是粗銅做陽極,精銅做陰極;含銅離子的溶液做電解質溶液;乙池是電解飽和食鹽水,總反應離子方程式為:2Cl-+2H2O $\frac{\underline{\;電解\;}}{\;}$Cl2↑+2OH-+H2↑;
(2)甲池是精煉銅,增重12.8g是銅的質量,根據電解反應過程中電極上的電子守恒計算;
(3)依據析出銅的物質的量結合電子守恒計算生成的氫氧化鈉的物質的量,來計算濃度.
解答 解:圖示是兩個串聯的電解池,依據電源判斷A為陰極,B為陽極,Fe為陰極,C為陽極;
(1)依據電解原理精煉銅的裝置是粗銅做陽極,精銅做陰極;含銅離子的溶液做電解質溶液;所以A極是陰極;材料是精銅;電極反應為:Cu2++2e-=Cu;B為陽極;材料是粗銅;電極反應主要為:Cu-2e-=Cu2+;電解質溶液是CuSO4溶液;乙池是電解飽和食鹽水,總反應離子方程式為:2Cl-+2H2O $\frac{\underline{\;電解\;}}{\;}$Cl2↑+2OH-+H2↑;
故答案為:Cu2++2e-═Cu; Cu-2e-=Cu2+;2Cl-+2H2O $\frac{\underline{\;電解\;}}{\;}$Cl2↑+2OH-+H2↑;
(2)甲池是精煉銅,增重12.8g是銅的質量,物質的量為0.2mol,轉移電子物質的量為0.4mol;根據電解反應過程中電極上的電子守恒計算可知;乙槽陽極電極反應為:2Cl--2e-=Cl2↑放出氣體物質的量為0.2mol;在標準狀況下的體積為4.48L;
故答案為:4.48L;
(3)依據析出銅的物質的量為0.2mol,電子轉移為0.4mol,結合電子守恒和水電離出的氫離子和氫氧根離子守恒計算生成的氫氧化鈉的物質的量來計算濃度;電極反應為:2H++2e-=H2↑;減少氫離子物質的量為0.4mol,溶液中增多氫氧根離子物質的量為0.4mol,常溫下若乙槽剩余液體為400mL,則電解后得到堿液的物質的量濃度為1mol/L,故答案為:1mol•L-1.
點評 本題考查了電解池的工作原理的應用,電極判斷方法,電極反應的書寫,電子守恒的計算應用,串聯的電解池,電極的分析判斷,電路中電子守恒是解題關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,2.24 L乙醇中含有的C-H鍵數目為0.5NA | |
| B. | 標準狀況下,2.24 L NO和2.24 L O2混合后氣體分子數為0.15NA | |
| C. | 通常狀況下,3.36 L氯氣與2.7 g鋁充分反應轉移的電子數等于0.3NA | |
| D. | 由1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-數目為NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將銅絲插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 漂白粉中加入濃鹽酸:ClO-+Cl-+H2O═Cl2↑+2OH- | |
| C. | 向Al2(SO4)3溶液中加入過量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀鹽酸:Na2SiO3+2H+═H2SiO3↓+2Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:2:1 | B. | 3:3:1 | C. | 7:7:9 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 氯氣是一種重要的化工原料,在工農業生產、生活中有著重要的應用.請你根據所學知識回答下列問題:
氯氣是一種重要的化工原料,在工農業生產、生活中有著重要的應用.請你根據所學知識回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液中由水電離出的c(H+)為1.0×10-3mol/L | |
| B. | 在Na2A、NaHA兩種溶液中,離子種類不同 | |
| C. | 在NaHA溶液中一定有c(OH-)+c(HA-)+2c(A2-)═c(Na+)+c(H+) | |
| D. | 在Na2A溶液中,c(Na+)>c(HA-)>c(A2-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com