
為測(cè)定碳酸鈣純度(設(shè)含雜質(zhì)SiO2),學(xué)生設(shè)計(jì)了如下幾個(gè)實(shí)驗(yàn)方案,請(qǐng)回答每個(gè)方案中的問題。
方案Ⅰ:
①稱取碳酸鈣樣品mg;
②加入過量鹽酸;
③收集并測(cè)定生成的氣體體積VmL。
問題:如果稱量樣品時(shí),砝碼底部有一處未被人發(fā)現(xiàn)的殘缺,那么測(cè)得的碳酸鈣純度會(huì)________(偏高、偏低、無影響)。
方案Ⅱ:
①稱取碳酸鈣樣品mg;
②用c mol•L-1鹽酸VmL(過量)溶解樣品;
③取溶解后的溶液![]() mL,用c′mol•L-1 NaOH溶液滴定,用去V′mL。
mL,用c′mol•L-1 NaOH溶液滴定,用去V′mL。
問題:(1)列出本實(shí)驗(yàn)中所用到的儀器名稱(除鐵架臺(tái)、燒壞、鐵架臺(tái)附件外)________。
(2)加鹽酸后是否需要濾出SiO2后再用NaOH滴定________(填選項(xiàng)編號(hào))。
A.需要 B.不需要 C.均可
(3)碳酸鈣純度計(jì)算公式________。
方案Ⅲ:
①稱取碳酸鈣樣品mg;
③高溫煅燒1000℃直至質(zhì)量不再改變,冷卻后稱量,質(zhì)量為m′g。
問題:(1)為什么要煅燒至1000℃且“直至質(zhì)量不再改變”?
(2)本方案中的“冷卻”如何操作?為什么?
方案Ⅳ:
①稱量碳酸鈣樣品mg;
②加入足量c mol•L-1鹽酸VmL使之完全溶解;
③過濾并取濾液;
④在濾液中加入過量c′mol•L-1Na2CO3溶液V′mL;
⑤將步驟④中的沉淀濾出、洗滌、干燥、稱量為m′g。
問題:(1)此方案中不需要的數(shù)據(jù)是________(填選項(xiàng)編號(hào))。
A.c′、V B.c′、V′ C.m′ D.m
(2)為減少實(shí)驗(yàn)誤差,必要的操作是________(填選項(xiàng)編號(hào))。
A.精確測(cè)定Na2CO3溶液體積V′mL
B.精確配制濃度c′mol•L-1Na2CO3溶液
C.將步驟③所得沉淀洗滌、洗液也應(yīng)并入④中
D.將步驟③所得沉淀洗滌、干燥、稱量其質(zhì)量m′g備用
(3)步驟⑤中要將沉淀進(jìn)行洗滌,如果未經(jīng)洗滌,則測(cè)定結(jié)果,碳酸鈣純度將________(偏高、偏低、無影響)。
綜上所述,你認(rèn)為四個(gè)方案中,最好的方案是________
其他方案的缺點(diǎn)分別是:
方案Ⅳ:沉淀的洗滌、干燥、稱量操作過程復(fù)雜,容易造成較大誤差。
方案Ⅰ:________。
方案Ⅲ:________。
方案Ⅰ:偏低 方案Ⅱ:(1)托盤天平、藥匙、酸、堿式滴定管、錐形瓶;(2)B;(3) 方案Ⅲ:(1)保證CaCO3完全分解。 (2)應(yīng)在干燥器中冷卻。防止生成的CaO與空氣中CO2、H2O反應(yīng),造成質(zhì)量改變而產(chǎn)生誤差。 方案Ⅳ:(1)A、B (2)C (3)偏低 最好的方案是方案Ⅱ 方案Ⅰ:氣體體積難以測(cè)量準(zhǔn)確,因?yàn)闅怏w體積受外界因素的影響太大 方案Ⅲ:實(shí)驗(yàn)室難提供1000℃的高溫
|
方案Ⅰ中,破碼底部有殘缺,會(huì)使稱量的碳酸鈣樣品的質(zhì)量比實(shí)際的質(zhì)量小,這樣測(cè)量出的CO2比實(shí)際小,從而計(jì)算出的純碳酸鈣的質(zhì)量偏小,則純度的計(jì)算中分子偏小,分母不變,仍為mg,使結(jié)論偏低。 方案Ⅱ:①根據(jù)實(shí)驗(yàn)步驟來確定實(shí)驗(yàn)儀器。第一步:稱量?jī)x器如托盤天平、藥匙。第二步:鹽酸與碳酸鈣反應(yīng),儀器是燒杯。第三步:中和滴定,NaOH溶液滿定過量的鹽酸,儀器是堿式滴定管,酸式滴定管(可用來取V/10mL的反應(yīng)液),錐形瓶。②因?yàn)镹aOH在滴定時(shí)不會(huì)過量也不可能與SiO2反應(yīng)。故無需過濾。方案Ⅱ(3)… n(HCl)=2n(CaCO3)+10n(NaOH) n( m(CaCO3)=M(CaCO3)×n(CaCO3)=100g•mol-1×
純度= 方案Ⅲ:(1)保證CaCO3充分分解。(2)應(yīng)在干燥器中冷卻。防止生成的CaO與空氣中CO2、H2O反應(yīng),造成質(zhì)量改變而產(chǎn)生誤差。 方案Ⅳ:(1)純度=
|



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:
| V | 10 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:閱讀理解
| V | 10 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
 為測(cè)定碳酸鈣純度(設(shè)所含雜質(zhì)為SiO2),同學(xué)們?cè)O(shè)計(jì)了如下兩個(gè)實(shí)驗(yàn)方案:
為測(cè)定碳酸鈣純度(設(shè)所含雜質(zhì)為SiO2),同學(xué)們?cè)O(shè)計(jì)了如下兩個(gè)實(shí)驗(yàn)方案:查看答案和解析>>
科目:高中化學(xué) 來源:2010年海南省海口市高三下學(xué)期高考調(diào)研(一)化學(xué)試題 題型:實(shí)驗(yàn)題
(9分)為測(cè)定碳酸鈣純度(設(shè)所含雜質(zhì)為SiO2),同學(xué)們?cè)O(shè)計(jì)了如下兩個(gè)實(shí)驗(yàn)方案:
【方案I】
(1)組裝發(fā)生并測(cè)定生成氣體體積的實(shí)驗(yàn)裝置,并檢驗(yàn)氣密性;
(2)稱取碳酸鈣樣品W g;
(3)加入過量鹽酸;
(4)收集并測(cè)定生成的氣體體積V mL。
問題I—1:如果稱量樣品時(shí),砝碼底部有一處未被實(shí)驗(yàn)者發(fā)現(xiàn)的殘缺,那么測(cè)定的碳酸
鈣的純度會(huì) (填“偏高、偏低、無影響”)。
問題I—2:在方框中畫出測(cè)定生成的氣體體積的裝置簡(jiǎn)圖。

【方案II】
(1)稱取碳酸鈣樣品Wg;
(2)在錐形瓶中用C mol/L鹽酸V mL(過量)溶解樣品;
(3)加入甲基橙作指示劑,再用濃度為C1 mol/L的標(biāo)準(zhǔn)氫氧化鈉溶液滴定過量的鹽酸,用去氫氧化鈉溶液V1毫升。(已知甲基橙的變色范圍是pH=3.1~4.4)
問題II—1:未濾去不溶物SiO2,對(duì)測(cè)定結(jié)果是否有影響?(填有或無) ;
理由是 。
問題II—2:碳酸鈣純度表達(dá)式 。
【方案評(píng)價(jià)】
你認(rèn)為以上兩個(gè)方案中,最好的方案是 ,
另一個(gè)方案不夠好的理由是 。
查看答案和解析>>
科目:高中化學(xué) 來源:2010年廣東省高三10月月考化學(xué)試題 題型:實(shí)驗(yàn)題
(16分)為測(cè)定碳酸鈣純度(設(shè)含雜質(zhì)SiO2),學(xué)生設(shè)計(jì)了如下幾個(gè)實(shí)驗(yàn)方案。請(qǐng)回答每個(gè)方案中提出的問題。
【方案I】
(1)稱取碳酸鈣樣品 M g;
(2)加入過量鹽酸;
(3)收集并測(cè)定生成的氣體體積 V mL。
問題1:反應(yīng)結(jié)束后,量氣管中的顯示如右圖所示,接下來的操作是: ,讀出甲管中液面的讀數(shù)。
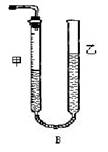
【方案II】
(1)稱取碳酸鈣樣品 M g;
(2)用c mol/L 鹽酸 V mL(過量)溶解樣品;
(3)取溶解后的溶液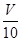 mL,以酚酞作指示劑,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示劑,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
問題2:列出本實(shí)驗(yàn)中所用到的主要儀器名稱(除鐵架臺(tái)及附件、燒杯之外) 。
問題3:碳酸鈣純度計(jì)算公式 。
問題4:當(dāng)碳酸鈣溶解完全后,少量未溶的SiO2沒過濾去,結(jié)果得到碳酸鈣純度________ (偏大、偏小或無影響)
【方案Ⅲ】
(1)稱取碳酸鈣樣品 M g;
(2)加入足量c mol/L鹽酸V mL使之完全溶解;
(3)過濾并取濾液;
(4)在濾液中加入過量c′ mol/L Na2CO3溶液V′mL;
(5)將步驟(4)中的沉淀濾出、洗滌、干燥、稱重為M′g。
問題5:此方案中不需要的數(shù)據(jù)是 (填選項(xiàng)編號(hào))。
A.c、V B.c′、 V′ C. M′ D. M
問題6:為減少實(shí)驗(yàn)誤差,步驟(3)、(5)過濾后都要對(duì)沉淀進(jìn)行洗滌,如果步驟(3)未經(jīng)洗滌,則測(cè)定的碳酸鈣的純度將 (偏大、偏小、無影響,下同);如果步驟(5)未經(jīng)洗滌,則測(cè)定的碳酸鈣純度將 。
問題7:判斷步驟(4)中Na2CO3溶液是否過量的方法是 。
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com