
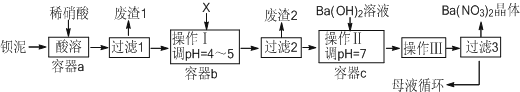
分析 鋇泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在a容器中充分溶解,可生成硫酸鋇,過濾后濾液中含有鐵離子、鋇離子等,且溶液呈酸性,可加入碳酸鋇,調節溶液pH=4~5,使鐵離子水解生成Fe(OH)3沉淀,過濾后廢渣2為Fe(OH)3,濾液中含有硝酸、硝酸鋇等,加入氫氧化鋇中和得到硝酸鋇溶液,經蒸發、濃縮、過濾可得到硝酸鋇晶體,母液中含有硝酸鋇,以此解答該題.
解答 解:(1)將BaCO3加入足量的飽和Na2CO3溶液中,存在BaSO4(s)?Ba2+(aq)+SO42-(aq),鋇離子與碳酸根離子結合生成碳酸鋇沉淀,使硫酸鋇的沉淀溶解平衡正移,從而轉化為碳酸鋇,其反應的離子方程式為:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),
故答案為:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq);
(2)Ba(FeO2)2與中鋇元素為+2價,鐵元素為+3價,所以反應產物為Ba(NO3)2和Fe(NO3)3,所以其反應方程式為:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案為:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X既要能中和硝酸,又不產生新雜質,結合工廠實際,應該用BaCO3來調節pH,
故答案為:B;
(4)已知Fe(OH)3和Fe(OH)2完全沉淀時,溶液的pH分別為3.2和9.7,流程中調節pH為4~5,所以三價鐵離子會完全轉化為沉淀Fe(OH)3,
故答案為:Fe(OH)3;
(5)從溶液中提取溶質的方法為:蒸發濃縮、冷卻結晶,然后過濾,所以操作Ⅲ為蒸發濃縮、冷卻結晶,
故答案為:蒸發濃縮、冷卻結晶;
(6)通過蒸發濃縮、冷卻結晶、過濾,得到硝酸鋇晶體,剩余的濾液中仍含有少量的Ba(NO3)2,所以含有Ba(NO3)2的母液應該,循環到容器c中,
故答案為:c;
(7)稱取w克晶體溶于蒸餾水,加入足量的硫酸,充分反應后,過濾、洗滌、干燥,稱量沉淀質量為m克,其發生的反應為:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
設參加反應的Ba(NO3)2為xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x m
則 $\frac{261}{x}$=$\frac{233}{m}$,解得x=$\frac{261m}{233}$,所以該Ba(NO3)2的純度為$\frac{\frac{261m}{233}}{w}$×100%=$\frac{261m}{233w}$×100%,
故答案為:$\frac{261m}{233w}$×100%.
點評 本題考查物質的制備,為高考常見題型,側重考查學生在“工藝流程閱讀、相關反應化學方程式書寫、化學反應條件控制的原理、生產流程的作用”等方面對元素化合物性質及其轉化關系的理解和應用程度,考查學生對新信息的處理能力,題目難度中等.


 暑假作業海燕出版社系列答案
暑假作業海燕出版社系列答案 本土教輔贏在暑假高效假期總復習云南科技出版社系列答案
本土教輔贏在暑假高效假期總復習云南科技出版社系列答案 暑假作業北京藝術與科學電子出版社系列答案
暑假作業北京藝術與科學電子出版社系列答案 第三學期贏在暑假系列答案
第三學期贏在暑假系列答案科目:高中化學 來源: 題型:選擇題
| A. | c(H+) | B. | Ka(HF) | C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$ | D. | $\frac{c({H}^{+})}{c(HF)}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
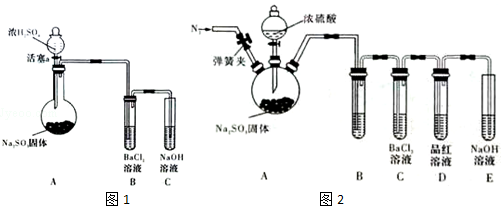
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | b>a>c | B. | a>c>b | C. | c>a>b | D. | c>b>a |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
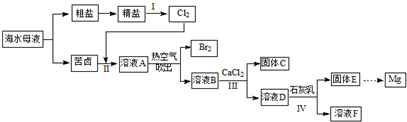
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
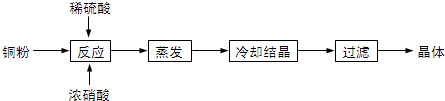
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
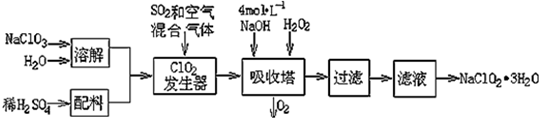
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
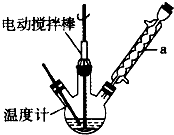 苯甲醛(
苯甲醛(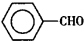 )、苯甲酸(
)、苯甲酸(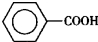 )都是重要的化工原料,都可用甲苯(
)都是重要的化工原料,都可用甲苯(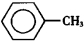 )為原料生產.下表列出了有關物質的部分物理性質,請回答:
)為原料生產.下表列出了有關物質的部分物理性質,請回答:| 名稱 | 性狀 | 熔點(℃) | 沸點(℃) | 相對密度 ρ水=1g/cm3 | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 無色液體易燃易揮發 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 無色液體 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片狀或針狀晶體 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
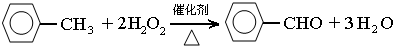 .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com