
【題目】常溫下,向25 mL 0.1 mol·L-1NaOH溶液中逐滴滴加0.2 mol·L-1的HN3(疊氮酸)溶液,pH的變化曲線如圖所示(溶液混合時體積的變化忽略不計,疊氮酸的Ka=10-4.7)。下列說法正確的是
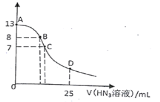
A. 0.1 mol·L-1 NaN3溶液pH約為8.85
B. 在B點,離子濃度大小為c(OH-)>c(H+)>c (Na+)>c(N3-)
C. 在C點,滴加的V(HN3)<12.5 mL
D. 在D點,c(Na+)=2c(HN3)+2 c(N3-)
【答案】A
【解析】
A.疊氮酸根的水解反應的平衡常數K=Kw/Ka(HN3)=[c(HN3)·c(OH-)]/ c(N3-)= c(OH-)2/ c(N3-),即![]() ,解得c(OH-)=10-5.15,所以c(H+)=10-8.85,則pH約為8.85,故A正確;
,解得c(OH-)=10-5.15,所以c(H+)=10-8.85,則pH約為8.85,故A正確;
B.B點呈堿性,則c(OH-)>c(H+),由于pH=8,混合液中的氫離子、氫氧根離子濃度較小,則正確的離子濃度大小為:c(Na+)>c(N3-)>c(OH-)>c(H+),故B錯誤;
C.滴加的V(HN3)=12.5 mL時,恰好反應生成NaN3,N3-部分水解,溶液呈堿性,而C點溶液的pH=7,所以C點V(HN3)>12.5 mL,故C錯誤;
D.D點溶液中,c(NaN3)=c(HN3),根據物料守恒,2c(Na+)=c(HN3)+c(N3-),D項錯誤;
故選A。


 互動英語系列答案
互動英語系列答案 名牌學校分層周周測系列答案
名牌學校分層周周測系列答案科目:高中化學 來源: 題型:
【題目】苯甲酸甲酯是一種重要的工業原料,有機化學中通過酯化反應原理,可以進行苯甲酸甲酯的合成。有關物質的物理性質、實驗裝置如下所示:
苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
熔點/℃ | 122.4 | ﹣97 | ﹣12.3 |
沸點/℃ | 249 | 64.3 | 199.6 |
密度/g.cm﹣3 | 1.2659 | 0.792 | 1.0888 |
水溶性 | 微溶 | 互溶 | 不溶 |
實驗一:制取苯甲酸甲酯
在大試管中加入15g苯甲酸和一定量的甲醇,邊振蕩邊緩慢加入一定量濃硫酸,按圖A連接儀器并實驗。

(1)苯甲酸與甲醇反應的化學方程式為______________________________________。
(2)中學實驗室中制取乙酸乙酯時為了提高酯的產率可以采取的措施有___________________________
實驗二:提純苯甲酸甲酯
該實驗要先利用圖B裝置把圖A中制備的苯甲酸甲酯水洗提純,再利用圖C裝置進行蒸餾提純
(3)用圖B裝置進行水洗提純時,B裝置中固體Na2CO3作用是__________________。
(4)用圖C裝置進行蒸餾提純時,當溫度計顯示____________時,可用錐形瓶收集苯甲酸甲酯。
(5)最終制取15g苯甲酸甲酯,計算得苯甲酸甲酯的產率為______________(小數點后保留1位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】十九大 報告提出要“打贏藍天保衛戰”,意味著對大氣污染防治比以前更高。二氧化硫-空氣質子交換膜燃料電池將化學能轉變成電能的同時, 實現了制硫酸、發電、環保三位一體的結合,降低了成本提高了效益, 其理原如圖所示。下列說法錯誤的是
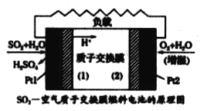
A.Ptl 電極附近發生的反應為:SO2+ 2H2O-2e- =SO42-+4H+
B.該電池放電時電子從Pt l電極經過外電路流到Pt2電極
C.Pt2電極附近發生的反應為O2+4e- =2O2-
D.相同條件下,放電過程中消耗的 SO2和O2的體積比為 2 : 1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】稀土元素包括鈧、釔和鑭系(含Ce、Eu )共17種元素, 是重要的戰略資源,我省稀土資源非常豐富.某彩色電視機顯示屏生產過程中產生大量的廢熒光粉末含 ( Eu2O3、SiO2、Fe2O3、CeO2、MnO 等物質).某課題組以此粉末為原料, 設計如下工藝流程對資源進行回收,得到較為純凈的CeO2和Eu2O3 (氧化銪).
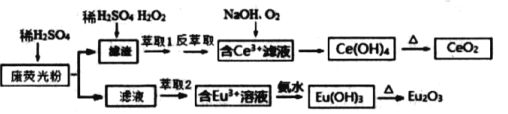
已知:CeO2 不溶于桸硫酸,也不溶于NaOH 溶液,Eu2O3可溶于稀硫酸
(1)往濾渣中加稀硫酸和H2O2進行酸浸,反應的離子方程式____________ 。為了提高酸浸率,可以適當提高反應溫度,但溫度偏高浸出率反而會減小,其原因是________________________________。
(2)有機物HR能將Ce3+從水溶液中萃取出來.該過程可表示為:Ce3+(水層)+3HR(有機層)![]() CeR3(有機層)+3H+(水層)。向 CeR3(有機層)中加入稀硫酸進行反萃取能獲得較純的含Ce3+水溶液,從平衡角度解釋其原因:________________________。
CeR3(有機層)+3H+(水層)。向 CeR3(有機層)中加入稀硫酸進行反萃取能獲得較純的含Ce3+水溶液,從平衡角度解釋其原因:________________________。
(3)流程中由含 Ce3+濾液生成Ce(OH)4的離子方程式____________________。
(4)取上述流程中得到的Ce(OH)4 產品 0.52 g, 加硫酸溶解后,用濃度為 0.1000molL-1FeSO4標準溶液滴定至終點時,鈰被還原為Ce3+ , 消耗 24.00 mL 標準溶液。該產品中 Ce(OH)4的質量分數為___________。
(5)已知含 Ce3+溶液也可以先加堿調 pH后再通入氧氣氧化可得到Ce(OH)4。298K 時,Ksp[Ce(OH)3]=5×10-20,若溶液中c(Ce3+)=0.05molL-1, 加堿調節pH 到_____時Ce3+開始沉淀(忽略加堿過程中溶液體積變化).
(6)萃取劑對金屬離子的萃取率與 pH的關系如圖所示.流程中為了用萃取劑除去金屬雜質離子,進行萃取2 最適宜的pH 是_______(填選項序號).其原因是 _____。
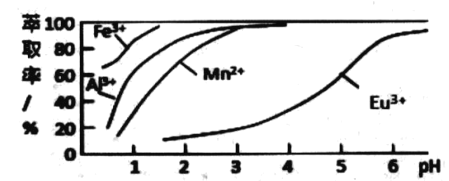
A. 2.0 左右 B . 3.0 左右 C. 5.0 左右
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鋇(Ba3N2)是一種重要的化學試劑。高溫下,向氫化鋇(BaH2)中通入氮氣反應生成氮化鋇。可用如圖裝置制備氮化鋇。已知:Ba3N2遇水反應;BaH2在潮濕空氣中能自燃,遇水反應。下列說法不正確的是( )
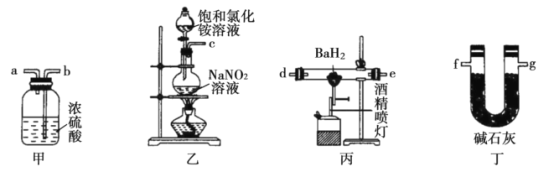
A.在實驗室中可以用裝置乙制備氯氣
B.實驗時,先點燃裝置丙中的酒精噴燈,后點燃裝置乙中的酒精燈
C.氣流從左向右的字母連接順序為c→b→a→d→e→g→f
D.裝置甲中的濃硫酸和裝置丁中的堿石灰作用相同,均可防止水蒸氣進入裝置丙中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙兩同學用下圖所示裝置進行實驗,探究硝酸與鐵反應的產物。
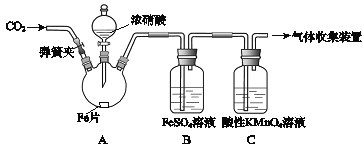
文獻記載:
I.在濃硝酸和活潑金屬反應過程中,隨著硝酸濃度的降低,其生成的產物有+4、+2、﹣3價等氮的化合物。
II.FeSO4+NOFe(NO)SO4(棕色) 。
III.NO2和NO都能被KMnO4氧化吸收。
甲的實驗操作和現象記錄如下:
實驗操作 | 實驗現象 |
(1)打開彈簧夾,通入一段時間某氣體,關閉彈簧夾。 | |
(2)打開分液漏斗活塞,將濃硝酸緩慢滴入燒瓶中,關閉活塞。 | 無明顯現象。 |
(3)加熱燒瓶,反應開始后停止加熱。 | ①A中有紅棕色氣體產生,一段時間后,氣體顏色逐漸變淺; B中溶液變棕色; C中溶液紫色變淺。 ②反應停止后,A中有固體剩余。 |
請回答下列問題:
(1)為排除空氣對實驗的干擾,操作(1)中通入的氣體可能是________________。
(2)滴入濃硝酸加熱前沒有明顯現象的原因是__________________________。
(3)試寫出加熱燒瓶后A中有紅棕色氣體產生的化學方程式_______________。
(4)甲認為B中溶液變棕色是因為A中有NO生成,你認為甲的觀點對嗎_________(填正確或錯誤)?請結合方程式簡述原因 ________________________________。
(5)檢驗是否生成﹣3價氮的化合物,應進行的實驗操作是________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化鉻(Cr2O3)的性質獨特,在冶金、顏料等領域有著不可替代的地位。一種利用淀粉水熱還原鉻酸鈉制備氧化鉻的工藝流程如圖:
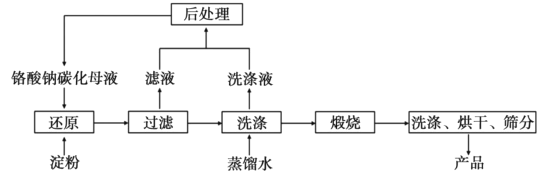
已知:①向含少量Na2CO3的鉻酸鈉堿性溶液中通入CO2可制得不同碳化率的鉻酸鈉碳化母液。
②“還原”反應劇烈放熱,可制得Cr(OH)3漿料。
(1)該工藝中“還原”反應最初使用的是蔗糖或甲醛,后來改用價格低廉的淀粉。請寫出甲醛(HCHO)與鉻酸鈉(Na2CrO4)溶液反應的離子方程式__。
(2)將混合均勻的料液加入反應釜,密閉攪拌,恒溫發生“還原”反應,下列有關說法錯誤的是__(填標號)。
A.該反應一定無需加熱即可進行
B.必要時可使用冷卻水進行溫度控制
C.鉻酸鈉可適當過量,使淀粉充分反應
D.應建造廢水回收池,回收含鉻廢水
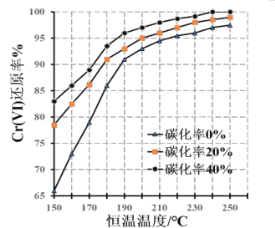
(3)測得反應完成后在不同恒溫溫度、不同碳化率下Cr(Ⅵ)還原率如圖。實際生產過程中Cr(Ⅵ)還原率可高達99.5%以上,“還原”階段采用的最佳反應條件為_、__。
(4)濾液中所含溶質為__。該水熱法制備氧化鉻工藝的優點有__、__(寫出兩條即可)。
(5)由水熱法制備的氫氧化鉻為無定型氫氧化鉻[2Cr(OH)3H2O]。將洗滌并干燥后的氫氧化鉻濾餅充分煅燒,失去質量與固體殘留質量比為_。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA代表阿伏加德羅常數的值,下列有關敘述正確的是
A. 標準狀況下,2.24LCl2與足量的NaOH溶液反應,轉移的電子數目為0.2NA
B. 標準狀況下,44.8 L NO與22.4 L O2混合后氣體中分子總數等于2NA
C. NO2和H2O反應每生成2 mol HNO3時轉移的電子數目為2NA
D. 1 mol Fe在氧氣中充分燃燒失去3NA個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第四周期的多數元素及其化合物在化工、醫藥、材料等領域有著廣泛的應用。回答下列問題:
(1) 基態Ti原子中,最高能層電子的電子云輪廓形狀為___,與Ti同周期的所有過渡元素的基態原子中,寫出任意一種最外層電子數與鈦不同的元素外圍電子排布式_____。
(2) 琥珀酸亞鐵片是用于缺鐵性貧血的預防和治療的常見藥物,臨床建議服用維生素C促進“亞鐵”的吸收,避免生成Fe3+,從結構角度來看,Fe2+易被氧化成Fe3+的原因是_________________。
(3) SCN— 可用于Fe3+的檢驗,寫出與SCN— 互為等電子體的一種微粒:_____。
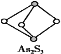
(4) 成語“信口雌黃”中的雌黃分子式為As2S3,分子結構如圖,As原子的雜化方式為______,雌黃和SnCl2在鹽酸中反應轉化為雄黃(As4S4)和SnCl4并放出H2S氣體,寫出該反應方程式:__________________。SnCl4分子的立體構型為_______。
(5)金紅石(TiO2)是含鈦的主要礦物之一,具有典型的四方晶系結構,其晶胞結構(晶胞中相同位置的原子相同)如圖所示(注意:D不在體心):
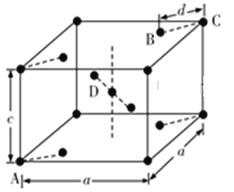
①4個微粒A、B、C、D中,屬于氧原子的是________________。
②若A、B、C原子的坐標分別為A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),則D原子的坐標為D(0.19a,____, ____);若晶胞底面邊長為x,則鈦氧鍵的鍵長d=_______(用代數式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com