
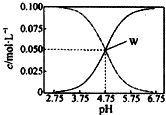
 25℃時,有均滿足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸與醋酸鈉的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )與pH的關系如圖所示.下列有關溶液中離子濃度關系的敘述中,不正確的是( )
25℃時,有均滿足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸與醋酸鈉的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )與pH的關系如圖所示.下列有關溶液中離子濃度關系的敘述中,不正確的是( )| A. | 25℃時,醋酸的電離常數K=1.0×10-4.75 | |
| B. | W點表示的溶液中:c(CH3COO-)=c(CH3COOH)>c( Na+) | |
| C. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO- )>c(H+)>c(OH- ) | |
| D. | pH=4.0的溶液中:c( Na+)+c(H+)+c(CH3COOH)-c(OH- )=0.10mol/L |
分析 根據圖象可看出,濃度增大的曲線應為c(CH3COO-),濃度減小的曲線應為c(CH3COOH),W點時c(CH3COOH)=c(CH3COO-),
A.根據電離平衡常數公式解答;
B.根據W點溶液中電荷守恒判斷;
C.pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH );
D.由電荷守恒及c(CH3COOH)+c(CH3COO-)=0.1mol•L-1分析.
解答 解:A.W點c(CH3COOH)=c(CH3COO-),pH=4.75,則c(H+)=10-4.75mol•L-1,平衡常數K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=10-4.75mol•L-1,故A正確;
B.溶液存在電荷守恒,應為c(Na+)+c(H+)=c(CH3COO-)+c(OH-),W點時,溶液顯酸性,則c(H+)>c(OH- ),所以W點表示的溶液中:c(CH3COO-)=c(CH3COOH)>c( Na+),故B正確;
C.隨著溶液中pH增大,c(CH3COO-)增大,pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH ),所以溶液中:c(CH3COO-)>c(CH3COOH )>c(H+)>c(OH- ),故C錯誤;
D.由電荷守恒及c(CH3COOH)+c(CH3COO-)=0.1mol•L-1可知,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=c(CH3COO-)+c(CH3COOH)=0.1mol/L,故D正確;
故選C.
點評 本題考查離子濃度大小比較,溶液中存在水解與電離兩個過程的離子濃度大小比較似乎是考試熱點內容,再結合守恒思想分析解答,題目難度中等.


 藍天教育暑假優化學習系列答案
藍天教育暑假優化學習系列答案科目:高中化學 來源: 題型:解答題
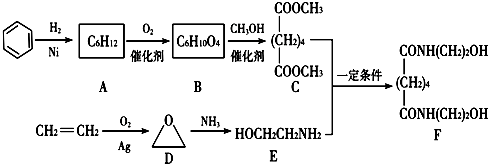
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化硅和二氧化碳在物理性質上有很大的差別 | |
| B. | 二氧化硅分子由一個硅原子和兩個氧原子構成 | |
| C. | 工業上用二氧化硅制粗硅 | |
| D. | 二氧化硅既能與氫氟酸反應,又能與燒堿反應,但它不是兩性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由水電離出的c(H+):④>③>①>② | |
| B. | ①、②和③等體積混合后的溶液:pH=7 | |
| C. | c(NH4+):③>④>① | |
| D. | ①和②等體積混合后的溶液:c(NH4+)+c(NH3•H2O)=0.1mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
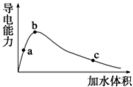 25℃時,將一定量的冰醋酸(即無水乙酸)加水稀釋,稀釋過程中溶液的導電性變化如圖所示.則下列說法錯誤的是( )
25℃時,將一定量的冰醋酸(即無水乙酸)加水稀釋,稀釋過程中溶液的導電性變化如圖所示.則下列說法錯誤的是( )| A. | 醋酸的電離度:a<b<c | |
| B. | 溶液中c(H+):b>a>c | |
| C. | a、b、c三點的溶液都有c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 從b點到c點,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化性強弱:D2>B2 | B. | D2能氧化C- | ||
| C. | 還原性強弱:A2+>B- | D. | 第二個反應中A3+是氧化產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
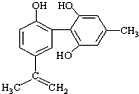 體育競技中服用興奮劑既有失公平,也敗壞了體育道德.某種興奮劑的結構簡式如圖所示.有關該物質的說法中,正確的是( )
體育競技中服用興奮劑既有失公平,也敗壞了體育道德.某種興奮劑的結構簡式如圖所示.有關該物質的說法中,正確的是( )| A. | 1mol該物質分別與濃溴水和H2反應時最多消耗和分別為4mol和7mol | |
| B. | 滴入酸性高錳酸鉀溶液振蕩,紫色褪去,能證明其結構中存在碳碳雙鍵 | |
| C. | 該物質與苯酚屬于同系物,遇溶液呈紫色 | |
| D. | 該分子中的所有碳原子不可能共平面 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
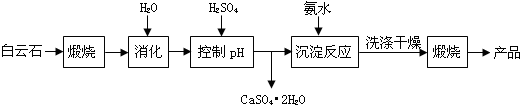
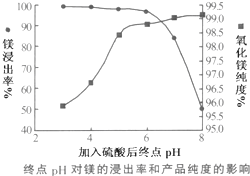
| 溫度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 顏色 | 黃色 | 綠色 | 藍色 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com